Quy trình xác nghiệm gen bằng kỹ thuật cIg FISH - Bộ y tế 2017
I. NGUYÊN LÝ
- Kỹ thuật cIg FISH là sự phối hợp 2 kĩ thuậtt là nhuộm bào tương của tế bào plasmo (tương bào) và k thu t FISH.
- Kỹ thuật nhuộm bào tương của tế bào plasmo được tiến hành theo nguyên lý: bào tương của tế bào plasmo biểu hiện rất nhiều kháng thể có chuỗi nhẹ kappa hoặc lambda. Sử dụng các kháng kháng thể đơn d ng (anti-kappa hoặc anti-lambda) đã được gắn huỳnh quang để nhuộm bào tương của tương bào sẽ giúp xác định dễ dàng các tế bào này thông qua kính hiển vi huỳnh quang với màng lọc phù hợp
- Kỹ thuật FISH được tiến hành dựa trên cơ sở của phản ứng lai ghép. Trong tế bào, phân tử ADN tồn tại dưới dạng ph n tử k p g m 2 chuỗi đơn gắn kết bổ sung với nhau thông qua liên kết hydro. Liên kết hydro là liên kết yếu nên dễ dàng bị đứt gãy dưới tác động của nhiệt độ hay pH cao. Lúc đó, ph n tử DN bị tách thành 2 chuỗi đơn. Tuy nhiên khi nhiệt độ hay pH giảm, các chuỗi đơn lại ghép nhau theo nguyên tắc bổ sung.
- Dựa trên đặc tính này, k thu t FISH sử d ng các probe là đoạn DN đặc hiệu có gắn huỳnh quang để lai gh p với các đoạn DN tương đ ng trên nhiễm sắc thể. Từ đó, chúng ta có thể phát hiện bất thường nhiễm sắc thể một cách chính xác và nhanh chóng.
- Sử dụng kỹ thuật cIg FISH giúp đánh giá những tổn thương di truyền khu trú trên d ng tế bào plasmo ác tính nên tránh được m tính giả.
II.CHỈ ĐỊNH
Chỉ định cho người bệnh đa u tủy xương, các bệnh lý liên quan đến tế bào lympho B.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
Nhân viên xét nghiệm di truyền - sinh học phân tử đã được đào tạo.
2. Phương tiện, hóa chất
2.1. Phương tiện
- Thiết bị: bể ổn nhiệt, máy lai, máy ly t m, máy trộn mẫu, và kính hiển vi huỳnh quang.
- Dụng cụ : kẹp kim loại, 10 cóng Coplin, nhiệt kế, coverslip 22x22, pipetman 100 μl, 10 μl, xi măng cao su, ống đong, giấy thấm.
2.2. Hóa chất
- Probe phù hợp tương ứng với đoạn gen cần phát hiện.
- Dung dịch 10% formamide: 5 ml formamide + 30 ml H2O + 15 ml 20X SSC.
- Dung dịch 2X SSC.
- Dung dịch rửa 0,1% NP40: 2X SSC + 0,1% NP40.
- Dung dịch rửa 0,3% NP-40: 0,4X SSC + 0,3% NP40.
- Cồn 70o, 85o, 100o.
- Ficoll Paque.
- Dung dịch PBS 1X.
- Dung dịch SSC 20X.
- Dung dịch nhược trương: KCL 0,075M (PH=7,4). (5 ml/1 mẫu).
- Methanol tuyệt đối.
- Acid acetic.
- Mounting medium without DAPI.
- AMCA Goat Anti human lambda chain antibody.
- AMCA Goat Anti human kappa chain antibody.
- AMCA Rabbit Anti goat IgG antibody.
- LSI/WCP Hybridization Buffer.
3. Bệnh phẩm
2 ml dịch hút tủy xương của người bệnh đ ng trong ống chống đông Sodium heparin.
V. CÁC BƯỚC TIẾN HÀNH
1. Chuẩn bị tiêu bản
Sau khi có dịch hút tủy xương của người bệnh, cần tiến hành k o tiêu bản và phân tích tỷ lệ tương bào. Với những mẫu có tỷ lệ tương bào lớn hơn 10%, thực hiện các bước chuẩn bị tiêu bản như sau:
B1: Tách tế bào đơn nh n bằng ficoll:
- Cho toàn bộ dịch tủy của người bệnh vào ống falcon 15 ml. Cho thêm dung dịch PBS 1X đến 3,3 ml.
- Thêm 1ml ficoll vào (lưu ý cho đầu côn chứa ficoll xuống đáy ống falcon). Ly t m 2100 v ng/phút trong 30 phút với chế độ “ no brake” cho máy ly tâm.
- Dùng pipet để b phần huyền dịch phía trên chứa huyết tương và tiểu cầu. Sử d ng pipet khác để chuyển phần tế bào đơn nh n sang ống falcon khác.
- Rửa bằng cách cho thêm PBS vào phần tế bào đơn nh n theo tỷ lệ 3:1. Ly t m 1400 v ng/phút trong 10 phút.
- Tái huyền dịch bằng PBS.
B2. Nhược trương tế bào:
- Xử lý tế bào đơn nh n bằng 5ml dung dịch KCl 0,075M trong 5 phút. Sau đó cho thêm 01 ml dung dịch Cornoy II (3 methanol: 1 acid acetic), trộn đều r i đem ly tâm 1000 v ng/phút trong 10 phút.
- Loại b dịch nổi.
B3. Cố định tiêu bản:
- Cho thêm 5ml dung dịch Cornoy II. Để ở nhiệt độ ph ng trong 10 phút.
- Ly t m 1000 v ng/phút trong 10 phút.
- Loại b dịch nổi.
- Cho thêm 5 ml cồn 96o. Ly t âm 1000 v ng/phút trong 10 phút.
- Tái huyền dịch để có n ng độ tế bào phù hợp, nh cặn tế bào lên lam kính.
2. Lai huỳnh quang tại chỗ
2.1. Xử lý tiêu bản
- Ngâm tiêu bản vào dung dịch 2X SSC ở 37±1oC trong 15 phút.
- Rửa tiêu bản qua cóng chứa dung dịch 2X SSC ở nhiệt độ ph ng trong 5 phút.
- Chuyển tiêu bản qua cóng chứa dung dịch formaldehyde 10% ở nhiệt độ ph ng trong 5 phút.
- Chuyển tiêu bản qua cóng chứa c n 700 trong 1 phút.
- Chuyển tiêu bản qua cóng chứa c n 850 trong 1 phút.
- Chuyển tiêu bản qua cóng chứa c n 1000 trong 1 phút.
- Để tiêu bản khô hoàn toàn ở nhiệt độ ph ng.
2.2. Chuẩn bị probe
- Trộn đều các dung dịch sau trong 1 ống PCR (1 μl probe + 7 μl LSI + 2 μl dH2O) /1tiêu bản
- Ly tâm nhẹ.
2.3.Lai
- Nhỏ 10 μl dung dịch probe vào khu v c đánh dấu trên tiêu bản sau đó che phủ bằng coverslip. Yêu cầu: dung dịch probe thấm đều trên tiêu bản, không có bọt khí.
- Phủ kín coverslip bằng cao su xi măng.
- Đặt tiêu bản vào máy lai, chọn chương tr nh biến tính ở 73oC trong 3 phút và ủ 37oC trong 16 - 20 giờ.
2.4. Rửa sau khi lai
- Gỡ b xi măng cao su và coverslip.
- Ng m và lắc mạnh tiêu bản lần lượt qua các cóng Coplin sau:
- Dung dịch (0,4X SSC/ 0,3% NP40): 2 phút, 73oC.
- Dung dịch (2X SSC/ 0,1% NP40): 1phút, nhiệt độ ph ng.
- Làm khô tiêu bản.
3. Nhuộm kháng thể tương bào
- Chuẩn bị 20 μl kháng kháng thể Kappa và Lambda/ tiêu bản (2 μl MC ntiHuman Kappa: 2 μl MC nti-Human Lambda : 16 μl PBS 1X).
- Nh 20 μl kháng kháng thể Kappa và Lambda lên bề mặt tiêu bản. Phủ kín tiêu bản bằng coverslip. Ủ trong tối ở 37oC tối thiểu 20 phút.
- Rửa qua 2 cóng chứa PBS 1X trong 2 phút mỗi cóng.
- Để tiêu bản khô hoàn toàn ở nhiệt độ ph ng.
- Chuẩn bị 20 μl kháng kháng thể Ig (H+L)/ tiêu bản (1 μl MC nti-Goat Ig (H+L): 19 μl PBS 1X).
- Nh 20 μl kháng kháng thể Ig (H+L) lên bề mặt tiêu bản. Phủ kín tiêu bản bằng coverslip. Ủ trong tối ở 37oC tối thiểu 20 phút.
- Rửa qua 2 cóng chứa PBS 1X trong 2 phút mỗi cóng.
- Để tiêu bản khô hoàn toàn ở nhiệt độ ph ng.
4. Phân tích kết quả
- Nh 10-20 μl dung dịch antifade lên bề mặt tiêu bản để chống mất màu probe và ổn định tín hiệu D PI trên tương bào.
- Phủ kín tiêu bản bằng coverslip. Yêu cầu: dung dịch dàn đều trên tiêu bản và không có bọt khí.
- Quan sát dưới kính hiển vi huỳnh quang với màng lọc thích hợp.
- Quy tắc ph n tích theo hướng dẫn c thể của nhà sản xuất cho từng loại probe. Thông thường sẽ tiến hành ph n tích 100 tương bào để đưa ra kết quả cuối cùng.
VI. NHỮNG SAI SÓT VÀ XỬ TRÍ
| Vấn đề | Nguyên nhân | Cách khắc phục |
| Không có tín hiệu hoặc tín hiệu yếu |
Kính hiển vi không thích hợp hoặc có sự cố |
Kiểm tra lại kính và các vật kính |
| Probe không biến tính hoàn toàn | Kiểm tra nhiệt độ bể ấm có đúng (73+/-1)oC | |
| Điều kiện lai không thích hợp |
Kiểm tra nhiệt độ tủ ấm có đúng 37oC hay không. Tăng thời gian lai lên 1giờ. |
|
| Điều kiện rửa không thích hợp |
Kiểm tra nhiệt độ bể ấm có đúng 73oC Kiểm tra các thành phần dung dịch rửa (pH...) |
|
| Xuất hiện bọt khí giữa tiêu bản và coverslip | Loại bỏ bọt khí | |
| Bảo quản probe không đúng cách | Bảo quản probe ở -20oC, không ánh sáng | |
| Tín hiệu đặc trưng yếu | Điều kiện lai không thích hợp | Kiểm tra nhiệt đổ tủ ấm có đúng 37oC |
| Nhiệt độ dung dịch rửa quá thấp | Duy tr nhiệt độ dung dịch rửa ở (73+/-1)oC | |
| Nền quá bẩn | Tiêu bản làm già quá mức cho phép hoặc chứa nhiều tế bào chất | Tăng thời gian biến tính của tiêu bản lên 10 phút |
| Tiêu bản không sạch hoặc nhiều mảnh vỡ tế bào trên tiêu bản | Chuẩn bị lại tiêu bản | |
| Các mảnh ADN không sạch | Thực hiện lại bước rửa tiêu bản sau khi lai với formamide | |
| Dung dịch rửa sai thành phần và nhiệt độ | Kiểm tra lại dung dịch rửa | |
| Hình thái các tế bào bị co cụm, biến dạng | Để tiêu bản bị quá khô | Tăng độ ẩm hoặc tăng nhiệt độ bể ấm trong quá tr nh tiến hành thí nghiệm |
| Tiêu bản chưa được sấy khô trước khi biến tính |
Chuẩn bị lại xét nghiệm với tiêu bản mới Làm già tiêu bản trước khi tiến hành FISH 24 giờ Chuẩn bị lại xét nghiệm với tiêu bản mới |
|
| Tiêu bản chưa khô sau biến tính | Sấy tiêu bản ở nhiệt độ 45oC trong 10-15 phút sau biến tính | |
| Nhiệt độ bể ấm quá cao | Kiểm tra nhiệt độ bể ấm có đúng (73+/-1)oC | |
| Thời gian biến tính quá lâu | Giảm thời gian biến tính 1 phút | |
| Tín hiệu quá mạnh | Nồng độ probe sử dụng quá cao so với dải màu của KHV | Cố gắng chỉnh kính thay thế bằng các dải màu trung lập |
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật ngoại khoa chuyên khoa phẫu thuật tiết niệu - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017

Sau khi phơi nhiễm với virus herpes thì có thể phải sau từ 2 đến 12 ngày thì các triệu chứng mới xuất hiện và phát hiện được bằng các phương pháp xét nghiệm.

Phẫu thuật là một trong những phương pháp điều trị phổ biến nhất trong những trường hợp ung thư tuyến tiền liệt giai đoạn đầu. Hiện nay có nhiều kỹ thuật phẫu thuật khác nhau. Một kỹ thuật xâm lấn tối thiểu là phẫu thuật cắt tuyến tiền liệt có sự hỗ trợ của robot.
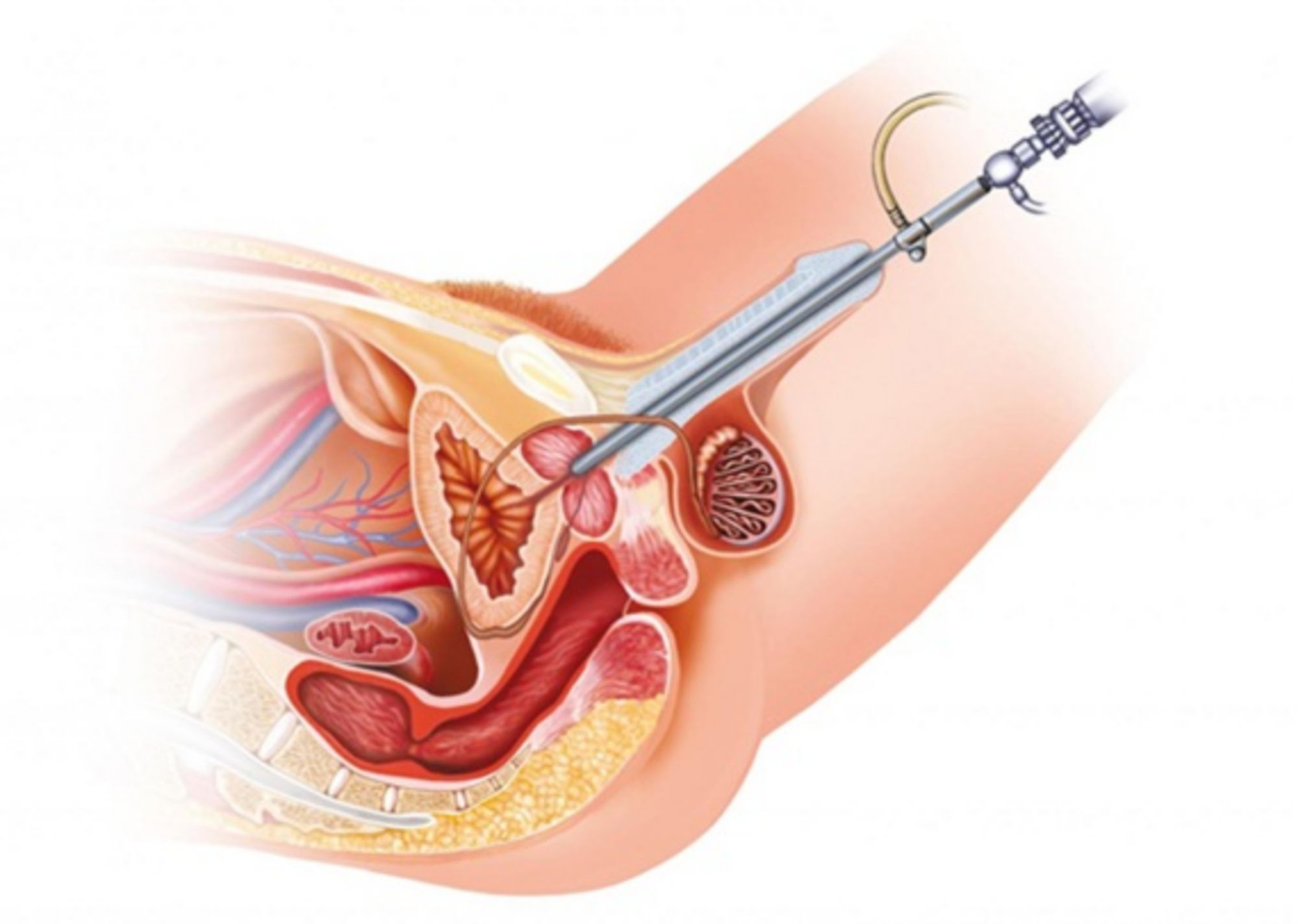
Treo cổ bàng quang là một giải pháp cho những trường hợp bị tiểu không tự chủ khi tăng áp lực nghiêm trọng, các triệu chứng gây cản trở cuộc sống hàng ngày và các phương pháp điều trị khác không hiệu quả.

Trong quá trình phẫu thuật cắt thận bằng robot. Bác sĩ điều khiển cánh tay của robot thực hiện các thao tác phẫu thuật. Phẫu thuật bằng robot có một số ưu điểm như độ chính xác cao hơn, giảm nguy cơ biến chứng và thời gian phục hồi nhanh hơn.

Bàng quang tăng hoạt (overactive bladder - OAB) là tình trạng cơ bàng quang co bóp không tự chủ, gây buồn tiểu liên tục. Cơn buồn tiểu có thể xảy đến đột ngột và người bệnh bị rò rỉ nước tiểu khi chưa kịp vào nhà vệ sinh. Bàng quang tăng hoạt gây ảnh hưởng lớn đến công việc, sinh hoạt hàng ngày, chức năng tình dục và giấc ngủ của người bệnh. Bàng quang tăng hoạt thậm chí còn ảnh hưởng đến cả sức khỏe tinh thần.
- 1 trả lời
- 1810 lượt xem
- Bác sĩ ơi, căng thẳng stress có gây trở ngại cho quá trình thụ thai không ạ? Cảm ơn bác sĩ!
- 1 trả lời
- 1329 lượt xem
- Thưa bác sĩ, cơ hội thụ thai sẽ được bao nhiêu sau thủ thuật đảo ngược triệt sản ạ? Bác sĩ giải đáp giúp tôi với nhé!
- 1 trả lời
- 1127 lượt xem
- Bác sĩ ơi, từ khi mang thai, nhiều lúc tôi có cảm giác người mình cứ chông chênh, đứng không vững. Bác sĩ có thể lý giải tình trạng mất cân bằng ở thai phụ giúp tôi không ạ? Cảm ơn bác sĩ!
- 1 trả lời
- 1441 lượt xem
- Bác sĩ ơi, bà bầu uống nước trái cây chưa được tiệt trùng bằng nhiệt có an toàn không ạ? Xin bác sĩ cho tôi một lời khuyên nhé? Cảm ơn bác sĩ!
- 1 trả lời
- 1096 lượt xem
- Thưa bác sĩ, con tôi năm nay 12 tuổi nhưng đã bị cận thị 4 đi - ốp. Bác sĩ cho tôi hỏi, trường hợp của chúa có thể phẫu thuật laser để trị cận thị không ạ?