Xét nghiệm virus ZIka bằng kỹ thuật PCR - Bộ y tế 2017
I. NGUYÊN LÝ
- Quy trình xét nghiệm vi rút ZIK d a trên x t nghiệm phát hiện v t liệu di truyền bằng phương pháp sinh học ph n tử, phương pháp này có thể là phản ứng chuỗi polymerase (PCR) hoặc phản ứng chuỗi polymerase thời gian th c (realtime PCR). Hiện nay, k thu t Realtime RT- PCR hay RT- PCR đã trở thành một công c được ứng d ng rộng rãi trong các l nh v c của y sinh học đặc biệt là l nh v c chẩn đoán bệnh với các tác nh n là vi rút.
- Kỹ thuật RT- PCR
- RN tổng số được tách từ mẫu bệnh phẩm l m sàng nghi nhiễm ZIK . Sau đó, RN được cho vào hỗn hợp RT-PCR với các cặp m i đặc hiệu cho vi rút ZIK . RN có thể được tách chiết từ mẫu bệnh phẩm l m sàng (máu, huyết thanh...) hoặc từ dịch nổi nuôi cấy tế bào.
- Kỹ thuật realtime RT- PCR
- Quy trình xét nghiệm vi rút ZIK dựa trên xét nghiệm phát hiện vật liệu di truyền bằng phương pháp sinh học phân tử, phương pháp này là phản ứng chuỗi polymerase thời gian thực (realtime PCR). Hiện nay, k thu t Realtime RT- PCR đã trở thành một công cụ được ứng dụng rộng rãi trong các lĩnh vực của y sinh học đặc biệt là lĩnh vực chẩn đoán bệnh với các tác nhân là vi rút. Phương pháp này sử d ng thêm bộ mẫu d phát huỳnh quang (probe) có khả năng phát hiện sản phẩm (vật liệu di truyền của vi rút) trong quá tr nh tổng hợp sản phẩm. Mẫu d là một đoạn oliognucleotit (vd: Taqman probe) được gắn với một chất nhuộm phát tín hiệu huỳnh quang ở đầu 5’ (R), đầu kia th được gắn với thuốc nhuộm d p tắt huỳnh quang (Q). Khi mẫu d c n nguyên vẹn, Q có vai trì nhận năng lượng phát ra từ R (hiệu ứng chuyển năng lượng huỳnh quang). Nếu có tr nh t đích, mẫu d và m i sẽ gắn vào khuôn, quá trình tổng hợp bắt đầu. Trong quá tr nh tổng hợp, enzym Taq DN polymerase với hoạt tính exonuclease sẽ cắt các nucleotid của mẫu dò từ đầu 5’, giải phóng R khỏi Q, làm tăng tín hiệu huỳnh quang của R. Càng nhiều sản phẩm tạo thành th càng nhiều mẫu dò bị phân cắt và tín hiệu của R phát ra càng nhiều. Mắt đọc tín hiệu huỳnh quang của máy sẽ thu tín hiệu R, xử lý bằng phần mềm và đưa ra kết quả cuối cùng.
II. CHỈ ĐỊNH
Các trường hợp nghi ngờ nhiễm virus ZIK .
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- -Kỹ thuật viên xét nghiệm đã được đào tạo thực hiện kỹ thuật;
- Trưởng khoa hoặc người được ủy quyền duyệt kết quả.
2. Phương tiện - Hóa chất
2.1. Điều kiện bảo quản
2.1.1. Hóa chất và sinh phẩm
- Hóa chất sinh phẩm sử d ng trong phản ứng sinh hoc ph n tử phải được bảo quản theo khuyến cáo của nhà sản xuất để đảm bảo tính ổn định của hóa chất/sinh phẩm.
- Khi sử dụng sinh phẩm cho pha chế, phải luôn được giữ lạnh và cất lại ngay sau khi dùng xong.
2.1.2. Dụng cụ tiêu hao và trang thiết bị
- Dụng cụ tiêu hao trong phòng thí nghiệm được bảo quản luôn thông thoáng. Khi sử dụng sẽ được ghi chép thông tin trong biểu mẫu phiếu theo d i v t tư.
- Trang thiết bị trong phòng thí nghiệm được bảo quản và vận hành trong khoảng nhiệt độ từ 25±5oC, độ ẩm từ 45-90%.
2.2. Hóa chất và sinh phẩm
2.2.1. Hóa chất
- Cồn tuyệt đối;
- Dung dịch đệm TBE x10;
- Thạch điện di.
2.2.2. Sinh phẩm
- QIAGEN Onestep RT-PCR: sinh phẩm dùng trong phản ứng RT-PCR
- Đệm PCR 5X (RT-PCR Bufer, 5x).
- dNTP: g m d TP, dCTP, dGTP, dTTP, ở n ng độ 10mM.
- Enzym Mix (Omniscript TM, Sensiscript TM và HotStarTaq DN polymeraza).
- Nước cất tinh sạch (RNase-Free Water).
- QuantiTect Probe RT-PCR kit - Qiagen: Sinh phẩm dung cho phản ứng Realtime RT-PCR.
- 2x QuantiTect Probe RT-PCR Master Mix.
- QuantiTect RT Mix 0.5 μl.
- Nước cất tinh sạch (RNase-Free Water).
- Bộ mồi cho phản ứng RT-PCR
| Mồi | Vị trí | Trình tự ( 5’-3’ ) | Nồng độ | |
|
Nhóm Flavivirus |
cFD2 | NS5 | GTGTCCCAGCCGGCGGTGTCATCAGC | 50 uM |
| MAMD | NS5 | ACATGATGGGRAARAGRGARAA | 50 uM | |
|
ZIKA nhóm chung |
ZIKVF | 1538-1558 | GCTGGDGCRGACACHGGRACT | 50 uM |
| ZIKVR | 1902-1883 | RTCYACYGCCATYTGGRCTG | 50 uM | |
|
ZIKA nhóm Asia |
ZIKVF9027a | 9121-9141 | CCTTGGATTCTTGAACGAGGA | 50 uM |
| ZIKVR9197c | 9312-9290 | AGAGCTTCATTCTCCAGATCAA | 50 uM | |
- Bộ mồi cho phản ứng real-time RT-PCR
Trình tự các cặp mồi và probe cho ZIK
| Mồi và probe | Trình tự (5'-3') | Nồng độ | |
|
Mồi định chung các nhóm (Genotype) |
Zika1087 | 5’-CCGCTGCCCAACACAAG-3’ | 100μM |
| Zika1108FAM | 5’-AGCCTACCTTGACAAGCAGTCAGACACTCAA-3’ | 100μM | |
| Zika1163c | 5’-CCACTAACGTTCTTTTGCAGACAT-3’ | 25 μM | |
| Mồi định nhóm Asian Genotype | Zika4481 | 5’-CTGTGGCATGAACCCAATAG-3’ | 100μM |
| Zika4507cFAM | 5’-CCACGCTCCAGCTGCAAAGG-3 | 100μM | |
| Zika4552c | 5’-ATCCCATAGAGCACCACTCC-3’ | 25μM | |
2.2.3. Chứng chuẩn:
- Chứng dương (Positive control – POS): ZIKA
- Chứng âm (No Template Control - NTC): sử d ng nước cất để kiểm tra qúa trình pha sinh phẩm hóa chất
- Chứng âm tách chiết (Negative Extraction Control – NEC): sử d ng nước cất để kiểm tra quá tr nh tách chiết
2.3. Dụng vụ tiêu hao và trong thiết bị
2.3.1. Dụng cụ tiêu hao
- Dụng cụ cho lấy mẫu
- Túi/hộp để đóng gói bệnh phẩm;
- Băng, gạc có tẩm chất sát trùng;
- Trang phục bảo hộ (găng tay, khẩu trang...);
- Bình lạnh bảo quản mẫu;
- Bơm tiêm 5 ml, vô trùng;
- Tube lấy máu (không có chất chống đông);
- Dây garo, bông, cồn bút ghi ...;
- Tube bảo quản mẫu ở -20oC;
- Hộp giấy đựng mẫu ở -20oC.
- Dụng cụ cho xét nghiệm
- Tube ly tâm 1.5 ml vô trùng;
- Tube ly t m 2.0 ml vô trùng;
- Pippetman: 10; 20; 100; 200 và 1000 l;
- Đầu côn lọc: 10; 30; 100; 200 và 1000 l;
- Tube tiệt trùng: 0.2; 0.5 và 1.7 ml;
- Giá tích lạnh;
- Tube 0,2 ml có nắp dành cho realtime RTPCR;
- Khay chạy điện di 100-250 ml và lược;
- Lò vi sóng 850-1300 W;
- Cốc đong 100-300 ml;
- Đĩa microtitre hoặc giấy parafilm;
- Bể nhuộm gel (nếu cần thiết).
2.3.2. Trang thiết bị
- Pipet;
- Máy lắc;
- Lò sấy;
- Cồn điện tử;
- Máy luân nhiệt;
- Bể điện di;
- Máy chụp Gel;
- Máy ly tâm;
- Tủ an toàn;
- Tủ lạnh.
3. Mẫu bệnh phẩm
- Loại mẫu: huyết thanh, máu toàn phần, dịch tiết....
- Điều kiện bảo quản: bảo quản lạnh.
- Bảo quản tại nơi lấy mẫu: bảo quản bệnh phẩm tại nơi lấy mẫu từ 2°C-8°C,trong v ng 3 ngày mẫu sẽ được chuyển tới PTN, trong quá tr nh vận chuyển đến PTN giữ tại 2°C- 8°C.
V. CÁC BƯỚC TIẾN HÀNH
1. Tách chiết mẫu
- Kiểm tra độ đ ng nhất 560 l đệm VL có chứa chất mang RN trong tube 2 ml.
- Thêm 140 l mẫu vào 560 l dung dịch ly giải virut VL có chất mang RN.
- Trộn bằng máy trộn khoảng 15 giây, để tạo một hỗn dịch đ ng nhất giữa mẫu và đệm VL, ủ ở nhiệt độ ph ng 10 phút đảm bảo các hạt virut bị ly giải hoàn toàn, RN của virut bị ly giải được gắn vào chất mang RN.
- Ly tâm nhanh tube hỗn hợp khoảng 10 giây bằng máy ly tâm MICROFUGE để tất cả các dung dịch không dính trên nắp tube. Thêm 560l Ethanol (96-100%) vào mỗi tube, trộn đều bằng máy trộn trong 15 giây, Ethanol sẽ tủa các sợi RN.
- Ly tâm nhanh khoảng 10 giây.
- Cho 630 l hỗn dịch trên vào cột QI amp, ly t m 8.000 v ng trong 1 phút. Tất cả RN sẽ được gắn trên bề mặt màng Silicagel với s có mặt của chất mang RN. Chuyển cột sang tube 2ml mới.
- Mở nắp cột QI amp, lặp lại bước 6.
- Mở nắp cột QI amp, thêm 500l đệm W1. Đóng nắp và ly t m 8.000 v ng trong 1 phút. Chuyển cột spin sang tube 2ml sạch và loại b tube có chứa dịch lọc. W 1 có tác d ng loại b các thành phần không phải là RN có trên mặt màng Silicagel.
- Mở nắp cột QI amp, thêm 500l đệm W2. Đóng nắp và ly t m trong khoảng từ 12.000 v ng đến 14.000 v ng trong 3 phút. Chuyển cột QI amp sang tube2ml sạch và loại b tube có chứa dịch lọc. Và ly t m thêm 1 phút ở tốc độ từ 12.000 v ng đến 14.000 v ng để loại b hoàn toàn đệm W2.
- Chuyển cột spin QI amp vào tube ly t m sạch 1.5ml và loại b tube chứa dịch lọc cũ.
- Mở nắp cột spin QI amp, thêm 60l đệm VE và ủ ở nhiệt độ ph ng trong 1 phút. Ly t m 8.000 v ng trong 1 phút để toàn bộ RN tách kh i màng Silicagel. Sau khi ly t m toàn bộ RN của mẫu sẽ được thu h i trong dịch lọc.
- Lưu giữ ở -20oC hoặc -80oC trong thời gian 6 -12 tháng.
2. Pha chế hóa chất/sinh phẩm
- Mã hóa loạt pha chế
| Loại pha | Ký hiệu |
| Cặp mồi | pri |
| Đoạn dò (Probe) | prb |
| Sinh phẩm cho phản ứng RT-PCR | pcr |
| Sinh phẩm cho phản ứng Real-time RT-PCR | rtm |
| Thạch điện di | gel |
3. Pha thạch điện di
- Số lượng thành phần garose được chuẩn bị:
| Nồng độ Agarose | 1% | 2,5% |
| TBE x 1 (ml) | 100 | 100 |
| Agarose (g) | 1 | 2,5 |
| Ethidium bromid 10mg/ml ( l) | 10 | 10 |
- Cách đổ thạch:
- Đổ thạch bằng khay điện di có cài sẵn răng lược.
- Lượng garose và TBE ph thuộc vào n ng độ thạch và số lượng khuôn thạch cần chuẩn bị được tính theo bảng trên.
Ví dụ : Chuẩn bị 100 ml thạch 2,5%: cần 2,5 g garose bột và 100ml TBE. Cho garose bột và dung dịch TBE vào cốc thuỷ tinh. Làm tan garose bằng l vi sóng trong khoảng 3-4 phút, đảm bảo garose tan hoàn toàn.
- Để nguội khoảng 50-60oC r i cho 10 μl Ethidium bromide lắc đều, đổ dung dịch garose này vào khuôn điện di có cài sẵn răng lược. Sau khoảng 60 phút ở nhiệt độ phòng, khi gel đã đông, gỡ nhẹ nhàng răng lược ra. Bảo quản gel ở 4oC.
- Đặt tên cho loạt pha.
4. Pha cặp mồi cho phản ứng
- Nồng độ mồi tính theo đơn vị nmole (ghi trên tube m i đông khô).
- Trả lại nước khử ion theo khuyến cáo của nhà sản xuất để đạt n ng độ gốc.
- Nồng độ mồi sử dụng được pha từ nồng độ gốc.
- Chia ra các tube có thể tích từ 50 - 200 μl /1 loại m i/mẫu d và bảo quản tại -30oC.
- Đặt tên cho loạt pha
5. Pha sinh phẩm cho phản ứng RT-PCR
- Thành phần pha sinh phẩm cho phản ứng RT-PCR.
| TT | Sinh phẩm | Thể tích (μl) | Số lượng phản ứng (N) |
| 1 | Đệm PCR x5 | 4 | 4xN |
| 2 | Enzym | 0.8 | 0.8xN |
| 3 | dNTPs | 0.8 | 0.8xN |
| 4 | Mồi xuôi | 0.2 | 0.2xN |
| 5 | Mồi ngược | 0.2 | 0.2xN |
| 6 | Nước cất tinh sạch | 9 | 9xN |
| Tổng số | 15 | ||
| 7 | RN mẫu | 5 | |
| Tổng số | 20 | ||
- Đặt tên cho loạt pha
6.Pha sinh phẩm cho phản ứng Realtime-RT-PCR
- Thành phần pha sinh phẩm cho phản ứng Realtime RT-PCR
| T | Thành phần | Nồng độ | Thể tích (μl)/1 pư | Số lượng phản ứng (N) |
| 1 | 2x Reaction mix | 12.5 | 12.5xN | |
| 2 | 2 QuantiTect RT mix | 0.25 | 0.25xN | |
| 3 | Mồi xuôi | 100 μM | 0.25 | 0.25xN |
| 4 | Mồi ngược | 100 μM | 0.25 | 0.25 |
| 5 | Probe | 25 μM | 0.15 | 0.15xN |
| 6 | Nước cất tinh sạch | 6.6 | 6.6xN | |
| Tổng số | 20 | |||
| 7 | RNA | 5 | ||
| Tổng số | 25 | |||
- Đặt tên cho loạt pha
7. Quy trình RT-PCR
- Cài đặt thiết bị
- Cài đặt thiết bị cho máy PCR
- Chu trình nhiệt cho ZIK nhóm chung:
| Nhiệt độ (oC) | Thời gian | Chu kỳ lặp | Tên chương trình | |
| ZIKA nhóm chung | 50 | 30:00 | x 1 | |
| 95 | 15:00 | |||
| 95 | 0:30 | x 35 | ||
| 55 | 0:30 | |||
| 72 | 0:45 | |||
| 72 | 7:00 | X 1 | ||
| 10 | |
- Chu trình nhiệt cho ZIK nhóm sia:
| Nhiệt độ (oC) | Thời gian | Chu kỳ lặp | Tên chương trình | |
| ZIKA nhóm Asia | 50 | 30:00 | x 1 | |
| 95 | 15:00 | |||
| 94 | 0:15 | x 35 | ||
| 57 | 0:25 | |||
| 72 | 0:20 | |||
| 72 | 5:00 | X 1 | ||
| 10 | |
- Tra mẫu và chạy máy
- Cho 5 μl mẫu RN bệnh phẩm vào hỗn hợp sinh phẩm đã chuẩn bị cho phản ứng RT-PCR. Mẫu chứng dương: được thực hiện tại tủ an toàn mẫu.
- Đặt các tube vào máy, khởi động và kiểm tra chương tr nh trước khi chạy máy lu n nhiệt cổ điển theo yêu cầu x t nghiệm.
- Ghi ch p mã thiết bị sử d ng, block sử d ng (nếu có), ngày sử d ng vào (VR-5.3-QTQL.01-BM.05).
- Sau khi kết thúc quá tr nh chạy máy, mang các mẫu sang ph ng điện di và tiến hành điện di sản phẩm RT-PCR.
- Điện di sản phẩm
+ Chuyển sản phẩm PCR vào thạch
- Đặt thạch vào bể điện di theo đúng chiều d ng điện từ m sang dương r i cho TBE 1X ng p bản thạch sao cho dung dich đệm cách mặt thạch từ 1-2mm.
- Cho dung dịch đệm đặt mẫu (Loading Dye) vào từng giếng của đ a microtitre hoặc trên giấy parafilm với số lượng tương ứng với số mẫu cần phân tích. Đệm Loading chứa 50% Glycerol v v y có tác d ng k o DN xuống dưới đáy của giếng điện di và c n chứa Bromophenol Blue có tác d ng đánh dấu DN trong quá tr nh chạy.
- Trộn 9 l mỗi sản phẩm PCR với 1 l đệm đặt mẫu.
- Trộn 4 - 5 l thang chuẩn DN 100bp hoặc 1000 bp với 1 l đệm đặt mẫu.
- Chuyển dung dịch đã được trộn với nhau vào trong các giếng của bản thạch.
- Đóng nắp của bể điện di , chọn d ng điện 110V và thời gian 30 phút.
- Tắt máy điện di, chuyển thạch sang máy đọc
+ Soi và chụp ảnh
- Đặt bản thạch ngay ngắn trên máy đọc gel, b t đèn tím để đọc gel và ch p ảnh.
8. Quy trình real-time RT-PCR
- Cài đặt thiết bị
- Cài đặt chương tr nh cho máy Realtime PCR
| Nhiệt độ (oC) | Thời gian | Chu kỳ lặp | Tên chương trình | |
| ZIKA | 50 | 30:00 | x 1 | ZIKV.CDC.Lancioti |
| 95 | 15:00 | |||
| 95 | 0:15 | x 45 | ||
| 60 | 1:00 | |||
| Thu tín hiệu huỳnh quang | ||||
| 10 | |
- Tra mẫu và chạy máy
- Cho 5μl mẫu RN bệnh phẩm vào tube chứa hỗn hợp phản ứng realtime RT- PCR, ly t m nhanh và giữ trong giá tích lạnh.
- Khi tra mẫu phải nh p mã số mẫu vào sơ đ vị trí khung 96 giếng.
- Chú ý: Nếu chưa chạy ngay th nên giữ tube ở điều kiện 4oC.
- Đặt các tuýp vào máy, khởi động chương tr nh theo yêu cầu x t nghiệm.
VI. NHẬN ĐỊNH KẾT QUẢ
1.Nhận định kết quả RT-PCR
- Kết quả được chấp nhận khi:
- Chứng dương: có băng đặc hiệu tương đương với kích thước của cặp mồi thiết kế.
- Chứng âm phản ứng (NTC), chứng m tách chiết (NEC): âm tính.
- Âm tính: sự xuất hiện sản phẩm PCR ở các vị trí không đặc hiệu hoặc không có sự hiện diện của sản phẩm PCR.
- Dương tính: sản phẩm PCR đặc hiệu có kích thước theo đúng kích thước chuẩn.
- Kích thước sản phẩm PCR đặc hiệu.
| Dương tính | |
| RT-PCR | |
| Nhóm Flavivirus | 250 bp |
| Zika nhóm chung | 364 bp |
| Zika nhóm Asia | 192 bp |
- Trong trường hợp kết quả của phương pháp RT-PCR không cho kết quả r ràng hoặc trong trường hợp cần khẳng định chính xác kết quả, ph ng thí nghiệm sẽ x t nghiệm bằng phương pháp Realtime RT-PCR.
2.Nhận định kết quả Realtime-PCR
- Kết quả chỉ đọc được khi:
- Chứng âm: không có tín hiệu huỳnh quang.
- Chứng âm tách chiết: không có tín hiệu huỳnh quang.
- Mẫu dương tính: tín hiệu huỳnh quang được thu nh n trước hoặc tại chu kỳ thứ 38 của phản ứng.
- Nếu trong trường hợp phương pháp Realtime RT - PCR vẫn cho kết quả không r th mẫu bệnh phẩm này sẽ được lặp lại từ bước tách chiết mẫu và có thể chạy song song hai phương pháp RT-PCR và Realtime PCR; hoặc PTN có thể yêu cầu lấy lại bệnh phẩm và x t nghiệm theo thường quy của ph ng từ bước nhận bệnh phẩm.
- Ghi chép và báo cáo
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật ngoại khoa chuyên khoa phẫu thuật tiết niệu - Bộ y tế 2017

Những phụ nữ bị mụn rộp sinh dục và đang mang thai cần điều trị bằng liệu pháp ức chế virus nhằm giảm nguy cơ lây truyền virus sang con trong khi sinh và giảm khả năng phải sinh mổ.

Sau khi phơi nhiễm với virus herpes thì có thể phải sau từ 2 đến 12 ngày thì các triệu chứng mới xuất hiện và phát hiện được bằng các phương pháp xét nghiệm.

Dù là ở bất kỳ giai đoạn nào của HIV thì việc theo dõi số lượng tế bào CD4 và tải lượng virus vẫn là điều rất cần thiết.

Phẫu thuật là một trong những phương pháp điều trị phổ biến nhất trong những trường hợp ung thư tuyến tiền liệt giai đoạn đầu. Hiện nay có nhiều kỹ thuật phẫu thuật khác nhau. Một kỹ thuật xâm lấn tối thiểu là phẫu thuật cắt tuyến tiền liệt có sự hỗ trợ của robot.
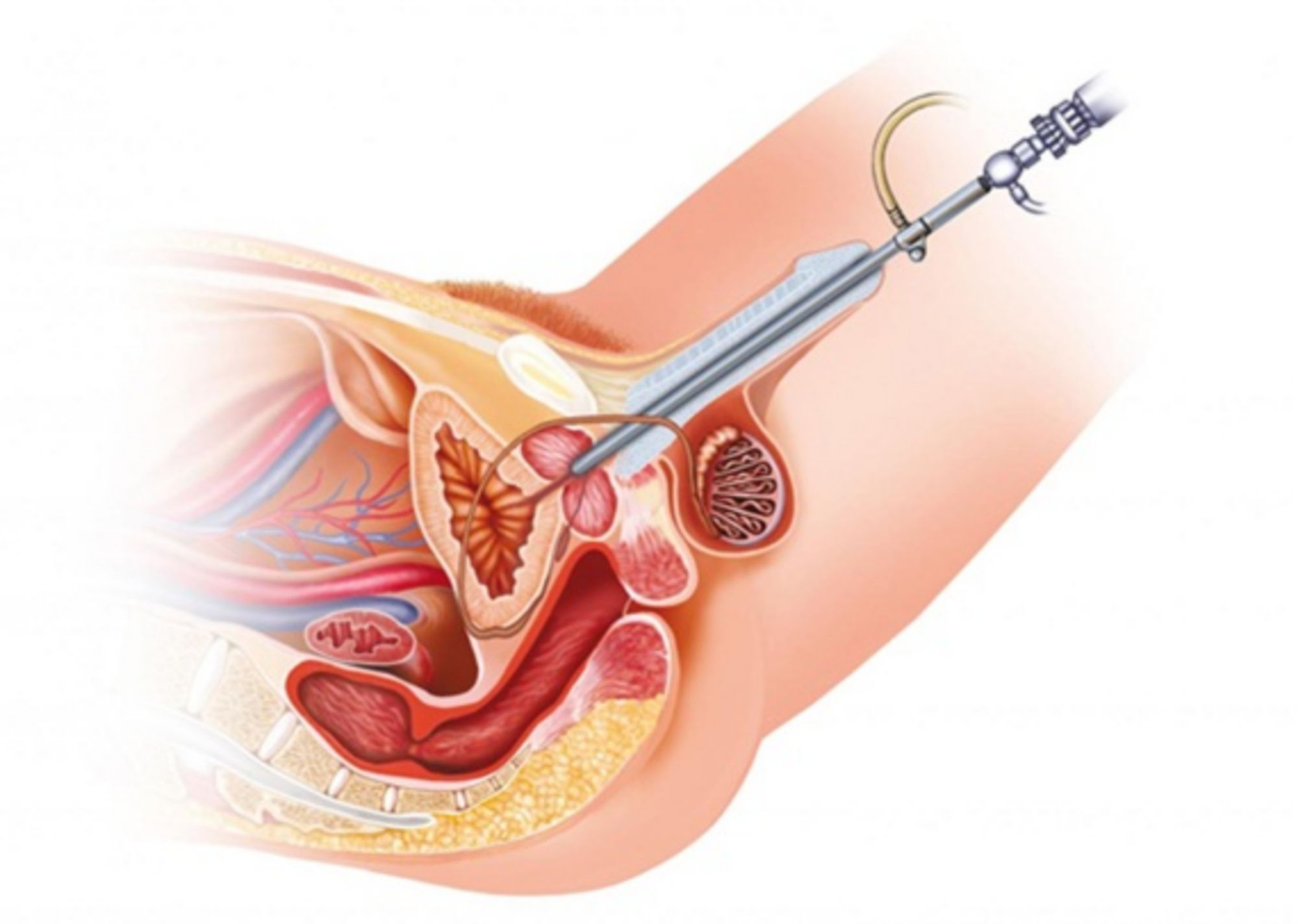
Treo cổ bàng quang là một giải pháp cho những trường hợp bị tiểu không tự chủ khi tăng áp lực nghiêm trọng, các triệu chứng gây cản trở cuộc sống hàng ngày và các phương pháp điều trị khác không hiệu quả.
- 1 trả lời
- 1329 lượt xem
- Thưa bác sĩ, cơ hội thụ thai sẽ được bao nhiêu sau thủ thuật đảo ngược triệt sản ạ? Bác sĩ giải đáp giúp tôi với nhé!
- 1 trả lời
- 1127 lượt xem
- Bác sĩ ơi, từ khi mang thai, nhiều lúc tôi có cảm giác người mình cứ chông chênh, đứng không vững. Bác sĩ có thể lý giải tình trạng mất cân bằng ở thai phụ giúp tôi không ạ? Cảm ơn bác sĩ!
- 1 trả lời
- 1441 lượt xem
- Bác sĩ ơi, bà bầu uống nước trái cây chưa được tiệt trùng bằng nhiệt có an toàn không ạ? Xin bác sĩ cho tôi một lời khuyên nhé? Cảm ơn bác sĩ!
- 1 trả lời
- 1096 lượt xem
- Thưa bác sĩ, con tôi năm nay 12 tuổi nhưng đã bị cận thị 4 đi - ốp. Bác sĩ cho tôi hỏi, trường hợp của chúa có thể phẫu thuật laser để trị cận thị không ạ?
- 1 trả lời
- 1022 lượt xem
- Bác sĩ cho tôi hỏi, tôi có nên làm sạch tai bé bằng tăm bông không ạ? Cảm ơn bác sĩ!