Xét nghiệm giải trình tự gen trên hệ thống Miseq- Bộ y tế 2017
I. NGUYÊN LÝ
Kỹ thuật giải trình tự gen trên hệ thống MiSeq dựa trên nguyên lý tổng hợp chuỗi (synthesis-based) bổ sung với gen đích; trong đó mỗi loại nucleotit sử d ng trong phản ứng giải trình tự được đánh dấu với một chất huỳnh quang khác nhau và được phát hiện bằng hệ thống quang học. Từ đó cho phép xác định chính xác tr nh t sắp xếp các nucleotit trên chuỗi DN hoặc RN.
II. CHỈ ĐỊNH
Chỉ định cho các người bệnh bị bệnh máu để phát hiện các đột biến gen gây bệnh.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định
IV. CHUẨN BỊ
1. Người thực hiện
Nhân viên xét nghiệm sinh học phân tử đã được đào tạo.
2. Thiết bị - hoá chất
2.1. Thiết bị vật tư tiêu hao
- Pipet: 0,2-2μl, 1-10μl, 10-100μl, 20-200μl, 100-1000μl;
- Đầu côn RN se-free, có màng lọc, loại 0,2-2μl, 1-10μl, 10-100μl, 20-200μl, 100-1000μl;
- Ống ly tâm 1,7ml RN se-free và ống ly t m không nắp 2ml;
- Ống PCR 0,2ml, RN se-free;
- Ống real-time PCR 0,2ml, RNAse-free;
- Ống đo nồng độ DN/ RN (Qubit)
- Ống falcon: 10ml, 50ml;
- Dao cắt gel;
- Giá từ;
- Máy ly tâm lạnh, để bàn;
- Máy lắc ủ nhiệt;
- Máy PCR;
- Máy lắc (vortex);
- Máy đo n ng độ DN/ RN Nanodrop, Qubit 2.0;
- Hệ thống điện di và ch p ảnh gel;
- Hệ thống đọc trình tự gen MiSeq;
- Máy tính cấu hình cao (khuyến nghị: Core i7, 16-32Gb RAM, 1-2Gb VRAM đồ hoạ, ổ cứng SSD 1TB) và phần mềm phân tích kết quả.
2.2. Hóa chất
- Agarose;
- Thuốc nhuộm gel;
- Loading dye;
- Gel marker;
- Đệm điện di TBE;
- H2O dùng cho sinh học ph n tử, RN se-free
- Cồn tuyệt đối ethanol và isopropanol dùng cho sinh học ph n tử;
- Kit tách chiết DN/ RN (QI Gene);
- Kit thôi gel (QI Gene);
- Kit tổng hợp cDN (Invitrogen);
- Kit đo nồng độ DN (Qubit)
- Kit chuẩn bị thư viện (Illumina Nextera XT);
- Kit định lượng thư viện (K P RQ-PCR library quatification);
- Kit chuẩn hoá thư viện (Sigma MPure XP);
- Kit đọc trình tự gen (Illumina MiSeq reagent kit v2 300 cycles);
3. Mẫu xét nghiệm
2ml máu ngoại vi hoặc dịch tuỷ xương đ ng trong ống chống đông với EDT .
V. CÁC BƯỚC TIẾN HÀNH
1. Tách chiết vật liệu di truyền (ADN/ARN) từ mẫu máu ngoại vi hoặc dịch tuỷ xương (sử dụng kit QIAGene)
- Thu tế bào bạch cầu buffy coat, rửa và tái huyền dịch trong 200μl PBS 1X;
- Chuyển 200μl tế bào bạch cầu sang ống ly t m 1,7ml;
- Thêm vào mỗi ống 400μl đệm RLT, trộn đều bằng bơm tiêm;
- Thêm vào mỗi ống 400μl ethanol 70%, trộn đều bằng đảo ngược ống;
- Chuyển toàn bộ dịch vào cột tách chiết, ly t m 1 phút ở 10.000 v ng/phút, loại bỏ phần dịch ở đáy ống;
- Thêm vào mỗi cột 700μl dung dịch RW1, ly t m 1 phút ở 10.000 v ng/phút, loại b phần dịch ở đáy ống;
- Thêm vào mỗi cột 500μl dung dịch RPE, ly t m 1 phút ở 10.000 v ng/phút, loại b phần dịch ở đáy ống;
- Chuyển cột sang ống 2ml mới, ly t m 1 phút ở 10.000 v ng/phút, loại b phần dịch ở đáy ống;
- Chuyển cột sang ống ly t m 1,7ml mới, thêm vào mỗi cột 50μl H2O, để ở nhiệt độ ph ng 5 phút, ly t m 1 phút ở 10.000 v ng/phút. Phần dịch thu được là RN đã được tinh sạch;
- Đo nồng độ RN bằng NanoDrop và bảo quản mẫu ở -80oC.
2. Thực hiện phản ứng phiên mã ngược (cDNA)
- Sử dụng 10pg-1μg RN để thực hiện phản ứng cDN với kit SuperScript VILO cDNA Synthesis kit;
- Chuẩn bị phản ứng theo bảng dưới đây:
| Sinh phẩm | T.phần/1 pứ |
| 5X VILO Reaction Mix | 4.0 |
| 10X SuperScript Enzyme Mix | 2.0 |
| RNA | (1μg) |
| H20 | đến 20 |
| Tổng thể tích | 20 |
- Chu trình nhiệt cho phản ứng tổng hợp cDNA
|25oC 10’ 42oC 60’ 85oC 5’|
- Sản phẩm cDN được bảo quản ở -20oC.
3. Phân lập gen đích
Phân lập gen đích từ cDN tổng số bằng PCR với bộ m i phù hợp (tham khảo quy tr nh PCR chuẩn). Gen đích là đoạn hoặc các đoạn DN cần phân tích, phục vụ chẩn đoán và điều trị cho mỗi loại bệnh khác nhau.
4. Tinh sạch gen đích bằng phương pháp thôi gel
- Điện di sản phẩm PCR (gen đích) trên gel agarose 1%, sử d ng marker phù hợp để định vị chính xác gen đích;
- Cắt khúc gel chứa băng sản phẩm cho vào ống ly t m 1,7ml và xác định trọng lượng;
- Sử d ng kit QI Gene MinElute Gel Extraction kit để tinh sạch sản phẩm PCR. Tất cả các bước ly t m đều th c hiện ở v ng quay ≥ 10.000g;
- Cho vào mỗi ống chứa sản phẩm PCR 3 lần thể tích đệm QG (mỗi 1mg gel được quy ước tương đương với 1 μl thể tích);
- Ủ ở 500C trong 10 phút để gel tan hoàn toàn;
- Thêm 1x thể tích c n isopropanol (ví d : 100 μl c n đối với 100mg gel) đảo nhẹ và chuyển toàn bộ dung dịch vào cột MinElute;
- Ly tâm cột MinElute 1 phút, loại bỏ dịch ở đáy ống;
- Cho vào mỗi cột 500 μl đệm QG, ly tâm 1 phút, loại bỏ dịch ở đáy ống;
- Cho vào mỗi cột 750 μl đệm PE, ly tâm 1 phút, loại b dịch ở đáy ống;
- Chuyển cột sang ống ly tâm mới, ly tâm 1 phút, loại b dịch ở đáy ống;
- Chuyển cột sang ống ly tâm 1,5ml, thêm vào mỗi cột 10 μl đệm EB (hoặc H2O), để ở nhiệt độ phòng 1 phút;
- Ly tâm cột 1 phút, thu dịch chứa DN (gen) đích, đo n ng độ bằng NanoDrop, bảo quản ở -20oC.
5. Chuẩn bị thư viện DNA
5.1. Phân mảnh DNA thành các đoạn có chiều dài khoảng 300 bp
- Chuẩn bị
- Rã đông các ống TM ( mplicon Tagment Mix), TD (Tagment DN Buffer), và các mẫu DN , giữ trong khay đá;
- Làm ấm ống NT (Neutralize Tagment Buffer) đến nhiệt độ ph ng;
- Sau khi rã đông, nhẹ nhàng đảo ngược các ống hóa chất 3-5 lần để trộn đều.
- Các bước thực hiện
- Ký hiệu ống PCR mới là NT ;
- Cho 10 μl dung dich đệm TD vào mỗi ống;
- Cho 5 μl hỗn hợp DN của từng mẫu vào mỗi ống NT riêng biệt;
- Thêm 5 μl TM vào các ống, hút nhả pipet 5 lần;
- Đậy nắp các ống và ly t m ở 280g, 20oC, trong 1 phút để đảm bảo các hóa chất được tập trung ở phần đáy ống;
- Đưa các ống NT vào máy PCR, ủ ở nhiệt độ 55oC trong 5 phút, sau đó giữ ở 1oC;
- Thêm vào mỗi ống NT 5 μl đệm, trộn đều bằng pipet 5 lần;
- Đậy nắp và ly tâm ở 280g, 20oC, trong 1 phút;
- Ủ các ống NT ở nhiệt độ phòng trong 5 phút để bất hoạt hoàn toàn enzyme.
5.2. Gắn mã đánh dấu (barcode)
- Chuẩn bị
- Rã đông hóa chất NPM (Nextera PCR Master Mix) và các index ở nhiệt độ phòng trong khoảng 20 phút, nhẹ nhàng đảo ống 3-5 lần.
- Các bước thực hiện
- Đặt các ống NT theo thứ t cố định trên đ a TruSeq Index Plate Fixture;
- Thêm 15 μl mastermix NPM vào từng ống NT ;
- Thêm vào mỗi ống NT 5 μl index 1 và 5 μl index 2 theo tổ hợp để ph n biệt các mẫu ph n tích;
- Loại b tất cả các nắp index đã dùng và thay bằng nắp mới (cung cấp theo kit);
- Đậy nắp các ống và ly t m ở 280g, 20oC, trong 1 phút;
- Tiến hành phản ứng PCR để gắn index theo chương tr nh sau:
| Nhiệt độ | Thời gian | Chu kỳ |
| 72oC | 3 phút | 1 vòng |
| 95oC | 30 giây | |
| 95oC | 10 giây | 12 vòng |
| 55oC | 30 giây | |
| 72oC | 30 giây | |
| 72oC | 5 phút | 1 vòng |
| 4oC | ∞ |
Sơ đồ phối hợp mã đánh dấu (barcode):
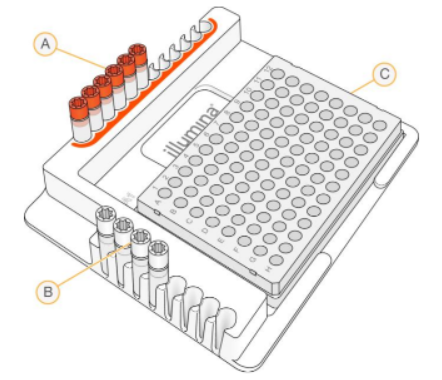
- A: Index N-7xx
- B: Index S-5xx
- C: Khay mẫu
5.3. Tinh sạch sản phẩm bằng hạt từ (AMPure XP)
- Chuẩn bị
- Đưa dung dịch chứa hạt từ MPure XP về nhiệt độ ph ng;
- Chuẩn bị cồn ethanol 80%.
- Các bước thực hiện
- Ly tâm ống NT ở 280g trong 1 phút (20oC);
- Đánh dấu ống ly t m 1,5, l mới là C ;
- Chuyển 50 μl sản phẩm PCR từ ống NT sang ống CAA;
- Trộn đều dung dịch MPure XP trong 30 gi y bằng vortex, thêm 90 μl AMPure XP vào từng ống C , trộn đều bằng pipet;
- Ủ ở nhiệt độ ph ng trong 5 phút để DN bám vào các hạt từ;
- Đặt ống trên giá từ trong 2 phút, để giữ hạt từ;
- Dùng pipet loại b toàn bộ dịch trong ống;
- Giữ nguyên ống C trên giá từ, thêm 200 μl ethanol 80% vào các ống, ủ 30 giây, loại bỏ dung dịch bằng pipet (th c hiện bước này 2 lần);
- Giữ nguyên các ống C trên giá từ, để khô t nhiên trong 15 phút;
- Nhấc các ống C khoti giá từ, dùng pipet thêm 50 μl đệm RSB vào từng ống C , trộn đều bằng pipet;
- Ủ ở nhiệt độ ph ng 2 phút. Sau đó đặt các ống lên giá từ trong 2 phút, dung pipet thu phần dung dịch (chứa DN ) đã tách ra kh i hạt từ. Ký hiệu các ống mẫu là CAN;
- Đo nồng độ bằng Qubit 2.0;
- Bảo quản mẫu ở nhiệt độ -20oC.
5.4. Định lượng mẫu bằng RQ-PCR
- Chuẩn bị
+ Pha loãng các mẫu sau khi tinh sạch theo tỷ lệ như sau:
- Nồng độ DN < 2 ng/μl: pha loãng 1.000 lần.
- Nồng độ DN từ 2 đến 10 ng/μl: pha loãng 5.000 lần.
- Nồng độ DN từ 10 đến 30 ng/μl: pha loãng 10.000 lần.
- Nồng độ DN >30 ng/μl: pha loãng 20.000 lần.
- Chương trình hạy RQ-PCR:
+ Công thức pha hỗn hợp phản ứng:
| Thành phần phản ứng | Thể tích/ hàm lượng |
| KAPA SYBR FAST qPCR Master mix | 12 μl |
| DN , standard (đã pha loãng) | 4 μl |
| H2O | 4 μl |
| Tổng thể tích | 20 μl |
- Chu trình nhiệt:
| Nhiệt độ | Thời gian | Chu kỳ |
| 95oC | 5 phút | 1 vòng |
| 95oC | 30 giây |
35 vòng, Đọc tín hiệu |
| 60oC | 45 giây | |
| 12oC | ∞ | - |
- Mỗi mẫu chạy lặp lại 3 lần để tính giá trị trung b nh;
- Kết quả định lượng bằng RQ-PCR được tính toán với kết quả đo bằng Qubit để tính giá trị trung b nh của mỗi mẫu, đ y là giá trị n ng độ cuối cùng của các mẫu dùng để tính toán lượng mẫu đưa vào đọc tr nh t .
5.5. Chuẩn hóa mẫu
- Chuẩn bị
- Rã đông ống LN 1 và làm ấm đến đến nhiệt độ ph ng;
- Làm ấm ống LNB1 và LNW1 đến nhiệt độ ph ng;
- Trộn đều ống LNB1 bằng vortex trong 1 phút;
- Làm ấm ống LNS1 về nhiệt độ ph ng.
- Các bước thự hiện
+ Đánh dấu một ống ly t m 1,5ml sạch là LNP;
+ Chuyển 20 μl dịch sản phẩm từ ống C N ống LNP;
+ Hút 1,1 ml LN 1 vào 1 ống ly t m 1,5 ml.
+ Trộn đều hạt từ trong ống LNB1 bằng pipet;
+ Hút 45 μl hỗn hợp LN 1/LNB1 vào mỗi ống LNP đã chứa sẵn mẫu;
+ Lắc các ống LNP trên ở v n tốc 1.800 v ng/phút trong 30 phút;
+ Đặt các ống trên giá từ trong 2 phút, loại b dung dịch bằng pipet;
+ Nhấc các ống LNP ra kh i giá từ và tiến hành bước rửa với LNW1:
- Thêm 45 μl LNW1 mỗi ống.
- Đóng chặt nắp các ống.
- Lắc với v n tốc 1.800 rpm trong 5 phút.
- Đặt các ống trên gía từ trong 2 phút.
- Cẩn th n loại b dịch nổi, thay đầu côn sau mỗi lần thao tác.
+ Lặp lại bước rửa một lần nữa với LNW1;
+ Nhấc các ống LNP kh i giá từ, thêm 30 μl NaOH 0,1 N vào các ống, lắc ống LNP tại v n tốc 1.800 v ng/phút, trong 5 phút;
+ Trong khi lắc, chuẩn bị ống PCR, ký hiệu là SGP, và cho vào mỗi ống 30 μl dung dịch LNS1;
+ Đặt các ống LNP trên giá từ trong 2 phút. Chuyển phần dung dịch chứa DN sang ống SGP;
+ Đo nồng độ bằng Qubit 2.0 và kit định lượng thư viện (K P library quantification).
+ Bảo quản mẫu ở nhiệt độ -20oC.
6. Giải trình tự gen trên máy MiSeq
- Đối với bộ hoá chất đọc tr nh t Reagent cartridge V2 300cycles, lượng mẫu đưa vào có n ng độ tối ưu là 12pMol;
- Pha loãng các mẫu và trộn tất cả các mẫu ph n tích vào cùng 1 ống ly t m và thêm dung dịch HT1 để đạt n ng độ cuối cùng là 12pMol.
- Chuẩn bị mẫu
- Điều chỉnh block nhiệt cho ống 1,5 ml đến 96oC;
- Rã đông hóa chất MiSeq reagent, để ở nhiệt độ ph ng;
- Chuẩn bị một hộp nước đá với tỷ lệ 3 đá - 1 nước;
- Làm ấm các ống SGP đến nhiệt độ ph ng, trộn đều bằng pipet;
- Ký hiệu 1 ống ly t m 1,5ml là ống P L;
- Chuyển 10 μl của mỗi mẫu trong mỗi ống SGP vào ống P L;
- Ký hiệu 1 ống ly t m 1,5ml mới là ống D L;
- Thêm 576 μl HT1 vào ống D L;
- Chuyển 24 μl hỗn hợp DN từ P L vào ống D L (có chứa HT1), trộn đều bằng pipet;
- Trộn ống D L bằng vortex với tốc độ cao nhất;
- Đưa ống D L vào block nhiệt ở 96oC, ủ trong 2 phút để đảm bảo các sợi DN bị biến tính hoàn toàn;
- Đảo nghịch ống D L 1-2 lần, đăt vào hộp nước đá, để trong v ng 5 phút;
- Đưa toàn bộ hỗn hợp trong ống D L vào khay đọc tr nh t (MiSeq reagent cartridge).
- Các bước tiến hành đọ trình tự gen
- Khởi động máy trước khi chạy 15 phút;
- Khởi động chương tr nh Experiment manager để khai báo thông tin mẫu và thiết lâlp quy trình chạy;
- Khởi động chương tr nh MiSeq control;
- Nạp hoá chất và khay mẫu vào vị trí tương ứng trên máy;
- Kiểm tra xác nh n của máy, khai báo thông tin trên màn h nh và tiến hành đọc trình tự.
- Kết thúc đọc trình tự gen
- Kiểm tra bảng thông báo kết quả đọc tr nh t gen;
- Tiến hành bước rửa thiết bị (post-run wash) theo hướng dẫn trên màn h nh.
VI. PHÂN TÍCH KẾT QUẢ
1. Phân tích kết quả bước 1 (primary data analysis): là bước đối chiếu, xắp xếp các đoạn đọc trình tự ngắn, thu được từ quá trình giải trình tự , thành các trình tự dài hơn (contig) và cuối cùng là các tr nh t hoàn chỉnh (gene hoặc genome). Bước này
được thực hiện t động với các chương tr nh, thu t toán cài đặt sẵn trong bộ công cụ
phân tích hệ gen (G TK).
2. Phân tích kết quả bước 2 (secondary data analysis): là bước phân tích dữ liệu theo hướng quan tâm (như xác định đột biến, đa h nh di truyền,...). Đối với hệ thống MiSeq, công c MiSeq reporter, cài đặt sẵn, ph c v đầy đủ các m c đích cơ bản. Ngoài ra, có nhiều công c tin-sinh khác (CLC genomic workbench, vadis,...) có thể được sử d ng để ph n tích và khai thác dữ liệu ở mức độ s u hơn.
VII. SAI SÓT VÀ XỬ TRÍ
| Vấn đề | Nguyên nhân | Cách khắc phục |
| DN không tinh sạch, lẫn ARN. |
- Lượng tế bào bạch cầu quá nhiều so với cỡ cột tách; - Bước rửa không thực hiện tốt. |
- Điều chỉnh lượng tế bào ban đầu theo mức phù hợp với cột; - Tăng thêm 1 bước rửa. |
| Tổng hợp gen đích không thành công |
- Mồi không đủ đặc hiệu; - Nồng độ các thành phần phản ứng không phù hợp; - Chưa tối ưu nhiệt độ. |
- Kiểm tra lại mồi, nồng độ các thành phần phản ứng và tiến hành chạy gradient nhiệt để tối ưu nhiệt độ phản ứng; |
| Kết quả đọc trình tự bị nhiễu |
- Thư viện DN không đạt đủ độ tinh sạch; - Biến tính chưa hoàn toàn; - Bước gắn barcode không thành công; - Lượng thư viện đưa vào quá nhiều; - Nhiễm chéo giữa các mẫu. |
- Kiểm tra bước tinh sạch và chuẩn hoá thư viện; - Đảm bảo nhiệt độ và thời gian biến tính; - Kiểm tra bước gắn barcode theo quy trình chuẩn; - Kiểm soát lượng thư viện đưa vào đọc trình tự ; - Đánh số và thay đầu côn sau khi thao tác với mỗi mẫu để loại bỏ nhiễm chéo. |
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật Ngoại khoa, chuyên khoa Phẫu thuật Tim mạch - Lồng ngực - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật Phục hồi chức năng - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật Phục hồi chức năng - Bộ y tế 2017

Chả mấy người khuyên phụ nữ mang thai nên “nghỉ ngơi trên giường (Bedrest)”. Nhưng việc bị gò bó ở nhà hoặc tệ hơn là ở một bệnh viện để tránh chuyển dạ sớm hoặc kiểm soát huyết áp cao là tình trạng phổ biến đến mức đáng ngạc nhiên.
Nếu đã được chẩn đoán mắc bệnh ung thư buồng trứng giai đoạn cuối thì bác sĩ sẽ đề nghị làm xét nghiệm di truyền tìm các đột biến gen BRCA, đặc biệt là khi có thành viên khác trong nhà cũng mắc ung thư buồng trứng.
![[GIẢI ĐÁP] Vấn Đề Tình Dục Ở Phụ Nữ Trên 60 Tuổi](/uploads/suc-khoe/2023_11/ham-muon-tinh-duc-phu-nu_3.png&w=800&h=533&checkress=ba809f6297fdb81ab241f2dab87cda12)
Phụ nữ càng lớn tuổi càng bị ảnh hưởng bởi nhiều yếu tố dẫn đến việc họ giảm hứng thú đối với quan hệ tình dục. Quan hệ tình dục ở những người phụ nữ lớn tuổi là một vấn đề khá nhạy cảm, nhưng không có nghĩa là ở họ hoàn toàn không tồn tại ham muốn tình dục.
Một hệ thống phân giai đoạn mới cho bệnh động mạch vành (CAD) sử dụng hình ảnh để đo lường mảng bám trong các động mạch vành. Các bác sĩ hy vọng rằng hệ thống này có thể giúp xác định những người có nguy cơ cao gặp phải các biến cố nghiêm trọng như nhồi máu cơ tim hoặc đột quỵ.
Bệnh cơ tim phì đại (HCM) là một bệnh tim di truyền gây dày thành tâm thất trái, khiến tim khó bơm máu đi khắp cơ thể. Xét nghiệm HCM thường được khuyến nghị cho những người có người thân cấp một được chẩn đoán mắc bệnh
- 1 trả lời
- 811 lượt xem
Mang thai được 3 tháng, em đi xét nghiệm máu ở Bv tỉnh có chỉ số HGB: 111.0 , Hct:0.336, MCV: 61,2 , MCH: 20,2. Còn chồng em, có chỉ số máu là: MCV 76,3 , MCH: 23,6 , MCHC: 309,0. Bác sĩ bảo vợ chồng em cần lên Bv Phụ sản TW làm thêm một số xét nghiệm máu cần thiết nữa. Mong được bs tư vấn ạ?
- 1 trả lời
- 692 lượt xem
Vợ em mang thai được gần 14 tuần, đi khám và làm một số xét nghiệm. Kết quả sàng lọc trước sinh, tất cả đều cho nguy cơ thấp. Độ mờ da gáy (NT) 215. Rubela-IgM Âm tính 0.53. Rubela-IgG Dương tính 60.7 (1 Nước tiểu pH 8.5 (4.5-7.5) Máu ++ 80 Âm tính hc/ul Tỉ trọng 1.015 (1.000-1.030) Bạch cầu + 70 Âm tính bc/ul. Bs cho em hỏi: các thông số trên, vợ em có điều gì bất thường không ạ?
- 1 trả lời
- 1808 lượt xem
- Bác sĩ ơi, căng thẳng stress có gây trở ngại cho quá trình thụ thai không ạ? Cảm ơn bác sĩ!
- 1 trả lời
- 1103 lượt xem
- Bác sĩ ơi, tôi thường mất ngủ khi phải nằm nghỉ rất nhiều trên giường để giữ thai nhi được khỏe mạnh. Bác sĩ có thể đưa ra lời khuyên giúp tôi có một giấc ngủ ngon hơn không ạ? Cảm ơn bác sĩ!
- 1 trả lời
- 1235 lượt xem
- Chào bác sĩ! Họng của con tôi bị sưng, đỏ. Bác sĩ cho tôi hỏi, cháu bị viêm họng thông thường hay bị viêm họng do strep (liên cầu khuẩn) gây nên ạ? Và những dấu hiệu nào thực sự là tình trạng nhiễm trùng vi khuẩn trep? Cảm ơn bác sĩ!