Đại cương về bệnh học ung thư và các phương pháp điều trị - Bộ y tế 2019
1. Các phương pháp điều trị bệnh ung thư
- Ung thư là một nhóm bệnh lý phức tạp, đa dạng về nguyên nhân, biểu hiện lâm sàng và tiến triển. Đây là một bệnh lý ác tính tế bào, trong đó các tế bào phân chia vô hạn độ, không theo sự kiểm soát của cơ thể, không chết theo chương trình, các tế bào ung thư xâm lấn phá hủy tổ chức xung quanh và di căn xa.
- Trong những năm gần đây, tỷ lệ người mới mắc và chết do ung thư có xu hướng ngày càng tăng ở hầu hết các quốc gia trên thế giới, nhất là ở các nước nghèo, các nước đang phát triển, trong đó có Việt Nam. Chẩn đoán và điều trị ung thư ở mỗi quốc gia ngày càng được quan tâm, nhiều phương pháp mới, hiện đại đã ra đời và mang lại kết quả khả quan. Tại các nước phát triển, khoảng 70% người bệnh ung thư tránh được tử vong nhờ các tiến bộ của y học trong việc phát hiện sớm và điều trị. Đặc biệt một số loại như: ung thư tuyến giáp, vú, cổ tử cung, vòm mũi họng, đại trực tràng, tuyến tiền liệt,... tỷ lệ chữa khỏi đạt trên 80%.
- Tại Việt Nam, theo đánh giá của Cơ quan nghiên cứu ung thư quốc tế (The International Agency for Research on Cancer - IARC), tỷ lệ chữa khỏi bệnh ung thư đạt 40%. Tỷ lệ này chưa được như mong muốn, lý do chủ yếu là phần lớn bệnh nhân ung thư ở nước ta đến khám và điều trị khi bệnh đã ở giai đoạn muộn. Theo Globocan 2018, hàng năm ở Việt Nam có 164.671 trường hợp ung thư mới mắc và 111.874 trường hợp tử vong. Tính chung cả hai giới nam và nữ thì các bệnh ung thư hay gặp là: ung thư gan, phổi, dạ dày, vú, đại trực tràng. Năm loại bệnh ung thư hay gặp ở nam giới là: ung thư gan, phổi, dạ dày, đại trực tràng, vòm mũi họng. Năm loại bệnh ung thư hay gặp ở nữ giới là: ung thư vú, đại trực tràng, phổi, dạ dày, gan.
- Hiện nay, việc phòng chống ung thư đi vào ba hướng chính: phòng bệnh, ứng dụng các tiến bộ trong sàng lọc, chẩn đoán, phát hiện sớm bệnh và ứng dụng các tiến bộ trong điều trị ung thư. Việc điều trị ung thư dựa vào nhiều yếu tố như: cơ quan, vị trí bị ung thư, giai đoạn bệnh, thể mô bệnh học, các dấu ấn sinh học phân tử, xét nghiệm gen...cũng như thể trạng của bệnh nhân. Phát hiện sớm, chẩn đoán đúng giai đoạn bệnh, lựa chọn phương pháp điều trị hợp lý có ý nghĩa quan trọng để đem lại hiệu quả điều trị cao cho người bệnh. Việc chẩn đoán dựa vào các triệu chứng lâm sàng, cận lâm sàng như: chẩn đoán hình ảnh, nội soi, sinh hóa, mô bệnh học, y học hạt nhân, sinh học phân tử,...Trong đó, mô bệnh học đóng vai trò quyết định trong chẩn đoán xác định.
- Đặc tính chung của bệnh ung thư là phát triển tại chỗ, xâm lấn tổ chức xung quanh, di căn theo đường bạch huyết và di căn xa qua đường máu tới các cơ quan khác. Chính vì vậy, điều trị bệnh ung thư tùy theo loại, giai đoạn bệnh, mô bệnh học, thể trạng người bệnh,...mà cần điều trị một hoặc phối hợp nhiều phương pháp trong đó phẫu thuật là phương pháp điều trị tại chỗ; xạ trị là phương pháp điều trị tại vùng; hóa chất, nội tiết, điều trị đích, miễn dịch là phương pháp điều trị toàn thân.
- Người bệnh ung thư khi bị bệnh thường có tâm lý hoang mang, lo lắng về bệnh, thậm chí một số trường hợp có biểu hiện trầm cảm. Bệnh ung thư giai đoạn muộn thường khiến người bệnh suy kiệt do các tế bào ung thư tăng sinh, nhân lên, xâm lấn, di căn. Do đó, ngoài việc điều trị bệnh ung thư, việc điều trị tâm lý và dinh dưỡng cũng cần được lưu ý. Hơn nữa, người bệnh ung thư đa số trên 50 tuổi, một số mắc các bệnh lý phối hợp, việc lựa chọn các thuốc điều trị nhằm mang lại hiệu quả cao, ít tác dụng phụ, ít có sự tương tác thuốc rất quan trọng.
- Do vậy, trong điều trị bệnh nhân ung thư cần có sự phối hợp của các chuyên gia y tế trong nhiều lĩnh vực khác nhau: bác sĩ nội khoa ung bướu, bác sĩ xạ trị ung bướu, phẫu thuật viên, bác sĩ giải phẫu bệnh, chẩn đoán hình ảnh, y học hạt nhân, bác sĩ dinh dưỡng, bác sĩ tâm lý, DSLS, điều dưỡng chuyên ngành ung bướu... Hiện nay, tại một số bệnh viện nước ta đã thành lập các nhóm hội chẩn ung bướu đa chuyên khoa (Multidisciplinary tumour board) để đưa ra chẩn đoán và lựa chọn phương pháp điều trị, chăm sóc tối ưu nhất cho từng người bệnh ung thư mang lại hiệu quả.
1.1. Các phương pháp điều trị tại chỗ
1.1.1 Phẫu thuật
- Phẫu thuật là phương pháp điều trị cơ bản, cho phép loại bỏ tổ chức ung thư, tuy nhiên chỉ thực hiện triệt để khi bệnh ở giai đoạn sớm, tổ chức khối u còn khu trú. Xu hướng hiện nay là tăng cường phẫu thuật bảo tồn u tối đa và phối hợp với các phương pháp điều trị khác (xạ trị, hóa trị, nội tiết, đích, miễn dịch) nhằm nâng cao chất lượngsống cho bệnh nhân.
- Các phương pháp phẫu thuật:
+ Phẫu thuật dự phòng bệnh ung thư là phẫu thuật cắt bỏ những thương tổn tiền ung thư, góp phần tích cực làm hạ thấp tỷ lệ mắc bệnh. Những phẫu thuật dự phòng có thể áp dụng như: cắt bao quy đầu giúp phòng ngừa ung thư dương vật, cắt polyp đại trực tràng giúp phòng tránh ung thư đại trực tràng.
+ Phẫu thuật chẩn đoán bệnh ung thư: nhằm lấy tổ chức ung thư làm xét nghiệm mô bệnh học, bao gồm nhiều phương pháp khác nhau như phẫu thuật lấy một phần khối u, phẫu thuật lấy hạch.
+ Phẫu thuật điều trị bệnh ung thư: có hai chỉ định chính là điều trị phẫu thuật triệt căn và phẫu thuật tạm thời.
- Phẫu thuật triệt căn trong ung thư: là phẫu thuật cắt bỏ rộng rãi khối u nguyên phát, các tổ chức lân cận, nạo vét hạch vùng để đảm bảo không còn tế bào ung thư; có thể phẫu thuật đơn thuần (với những trường hợp bệnh ở giai đoạn sớm, khu trú, chưa di căn xa) hoặc phẫu thuật phối hợp với các phương pháp điều trị khác.
- Phẫu thuật tạm thời: là phẫu thuật với mục đích dự phòng hoặc giải quyết biến chứng do bệnh gây ra, chỉ định cho những trường hợp bệnh ở giai đoạn muộn, tổn thương đã lan rộng.
+ Phẫu thuật tạo hình và phục hồi chức năng: như phẫu thuật tạo hình vú sau cắt tuyến vú để cải thiện chất lượng cuộc sống cho người phụ nữ.
+ Phẫu thuật điều trị nội tiết: phẫu thuật cắt buồng trứng trong ung thư vú, cắt tinh hoàn trong ung thư tuyến tiền liệt nhằm mục đích điều trị nội tiết.
+ Phẫu thuật trong trường hợp tái phát, di căn: tùy từng bệnh và vị trí di căn mà có các chỉ định phẫu thuật cụ thể.
1.1.2. Đốt sóng cao tần
- Đốt sóng cao tần (Radiofrequency ablation - RFA) là phương pháp phá hủy nhu mô khối u bằng nhiệt của dòng điện dao động với tần số 200-1200 kHz. Người ta đặt một điện cực ở trung tâm khối u và duy trì nhiệt độ phá hủy từ 60 -100°C. Dòng điện từ máy được truyền vào khối u qua một điện cực dạng kim (needle electrode), dòng sóng radio được truyền vào đầu kim và sinh nhiệt. Nhiệt do ma sát làm khô mô xung quanh dẫn đến làm mất nước trong tế bào và hoại tử đông khối u.

- Đốt sóng cao tần được chỉ định cho một số bệnh ung thư như: ung thư gan, ung thư tuyến giáp giai đoạn sớm, các khối u di căn..., có thể kết hợp với phương pháp khác để tăng hiệu quả điều trị.
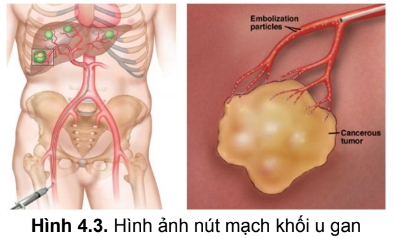
1.1.3. Nút mạch hóa chất
Nút mạch là đưa vật liệu tắc mạch vào trong động mạch cấp máu cho khối u. Nút mạch hoá chất là vừa nút mạch, vừa đưa hóa chất vào khối u. Do đó, khối u sẽ bị tiêu diệt theo hai cơ chế: thứ nhất, hóa chất được tập trung với nồng độ cao được bơm trực tiếp vào khối u mà không đi qua tuần hoàn của cơ thể nên có tác dụng tại chỗ tốt; ít tác dụng phụ toàn thân. Thứ hai, chất tắc mạch sẽ làm ngăn chặn dòng máu đến nuôi u, làm cho khối u thiếu máu, ngăn cản phát triển khối u. Nút mạch hóa chất thường được áp dụng trong điều trị ung thư gan.
1.1.4. Xạ trị
- Xạ trị cũng là một trong các phương pháp cơ bản điều trị bệnh ung thư, phương pháp này sử dụng các tia bức xạ ion hóa có năng lượng cao để tiêu diệt tế bào ung thư.
- Xạ trị bao gồm: xạ trị chiếu ngoài (Teletherapy, External Beam Radiotherapy - EBRT), xạ trị áp sát (brachytherapy), xạ trị chiếu trong bằng đồng vị phóng xạ hay còn gọi là xạ trị nguồn hở (unsealed source radiotherapy), cấy hạt phóng xạ là sự phối hợp giữa xạ trị áp sát và xạ trị chiếu trong.
+ Xạ trị chiếu ngoài: Xạ trị chiếu ngoài: nguồn phát bức xạ từ ngoài cơ thể, đây là phương pháp sử dụng các nguồn bức xạ ion hóa, hội tụ tại khối u và hạch vùng nhằm tiêu diệt tổ chức ung thư nhưng vẫn đảm bảo an toàn cho cơ quan lành xung quanh. Trong những năm gần đây, có nhiều tiến bộ về phương pháp xạ trị chiếu ngoài đó là các kỹ thuật mới như: xạ trị điều biến liều (Intensity Modulated Radiation Therapy - IMRT), xạ trị điều biến thể tích (Volumetric Arc Therapy - VMAT), xạ trị hạt nặng, xạ trị proton, xạ phẫu (radiosurgery), xạ trị định vị thân (Stereotactic Body Radiation Therapy - SBRT), xạ trị với PET/CT mô phỏng nhằm nâng cao liều bức xạ vào khối u và giảm liều bức xạ đến tổ chức lành xung quanh.
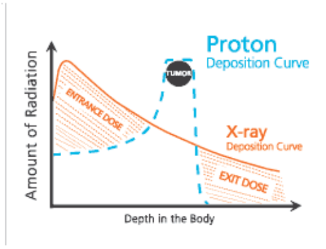
Hình 4.4. Hình ảnh so sánh hai phương pháp xạ trị photon và xạ trị proton
- Xạ trị photon (đường da cam, nét liền): Liều lượng bức xạ giảm dần trên đường đi, tổ chức lành trước và sau khối u đều chịu liều bức xạ lớn, biến chứng do xạ trị nhiều, phải sử dụng nhiều trường chiếu hội tụ tại khối u.
- Xạ trị proton (đường xanh nét đứt): Liều lượng bức xạ đạt mức tối đa khi đến khối u (điều chỉnh theo mức năng lượng), liều bức xạ trước khối u rất thấp và liều bức xạ sau khối u hầu như không có, do vậy rất ít biến chứng do xạ trị.
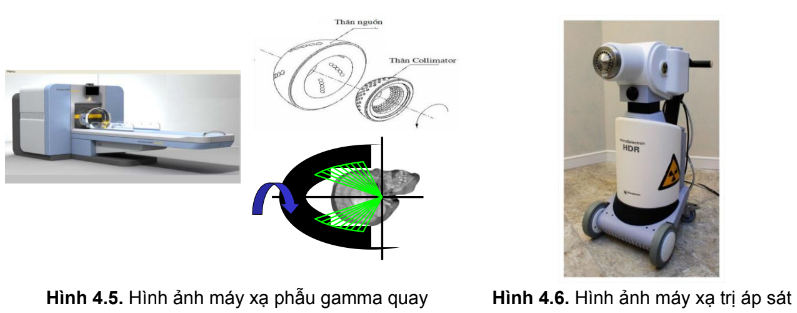
- Xạ phẫu, đặc biệt kỹ thuật xạ phẫu bằng dao gamma quay là một phương pháp xạ trị đặc biệt, trong đó các nguồn bức xạ quay xung quanh đầu bệnh nhân, hội tụ năng lượng rất lớn tại khối u, độ chính xác cao, gây hủy hoại khối u nhưng rất ít độc tính cho tổ chức lành xung quanh do liều bức xạ tại tổ chức lành rất thấp.
+ Xạ trị áp sát: Xạ trị áp sát: các nguồn xạ được đặt áp sát hoặc cắm trực tiếp vào trong vùng tổn thương hoặc đưa vào các khoang trong cơ thể. Ưu điểm của xạ trị áp sát là nâng liều bức xạ vào vị trí tổn thương ung thư (khối u, hạch) lên cao và hạn chế liều bức xạ vào các tổ chức lành xung quanh.
+ Xạ trị chiếu trong: Xạ trị chiếu trong: đưa nguồn xạ vào trong mô, tạng bên trong cơ thể qua đường uống, tiêm, truyền tĩnh mạch. Đây là phương pháp xạ trị mà thuốc phóng xạ tập trung vào đích là các tế bào ung thư và ít ảnh hưởng đến cơ quan lành xung quanh. Ví dụ: 131I trong điều trị ung thư tuyến giáp, 32P, 89Sr, 188Re trong điều trị giảm đau ung thư di căn xương
- Phương pháp xạ trị trong chọn lọc (Selective Internal Radiation Therapy - SIRT), hay tắc mạch phóng xạ (Radio Embolization - RE) là kỹ thuật sử dụng hạt vi cầu phóng xạ Yttrium-90 (90Y) đưa vào động mạch nuôi khối u gan. Tia beta (β) do 90Y phát ra tại chỗ sẽ tiêu diệt tế bào u mà không hoặc ít ảnh hưởng tới tổ chức lành xung quanh. Phương pháp này được áp dụng trong điều trị ung thư gan nguyên phát hoặc ung thư di căn gan.
- Cấy hạt phóng xạ điều trị ung thư tuyến tiền liệt: các hạt phóng xạ (125I hoặc 103Pd) có kích thước nhỏ được cấy trực tiếp vào tuyến tiền liệt, nên các tế bào ung thư sẽ nhận được liều bức xạ cao nhất và giảm thiểu tối đa liều bức xạ tới các cơ quan lành xung quanh. Đây là phương pháp phối hợp giữa xạ trị áp sát và xạ trị chiếu trong.

1.1.5. Miễn dịch phóng xạ (radioimmunotherapy - RIT) là phương pháp sử dụng khángthể đơn dòng đã được đánh dấu đồng vị phóng xạ phát tia beta (β) hoặc alpha (α) để gắn đặc hiệu vào kháng nguyên (nằm trên bề mặt tế bào ung thư). Các đồng vị phóng xạ có mức năng lượng bức xạ thấp và khả năng đâm xuyên ngắn (vài milimet trong tổ chức) nên các tế bào ung thư được nhận liều bức xạ cao nhất và bảo vệ tối đa các tế bào lành xung quanh. Đây là phương pháp phối hợp xạ trị chiếu trong với kháng thể đơn dòng (điều trị toàn thân): ibritumomab tiuxetan gắn với 111In hoặc 90Y (Zevalin), tositumomab gắn với 131I (Bexxar), nimotuzumab gắn với 131I và 90Y...
1.2. Các phương pháp điều trị toàn thân
1.2.1. Hóa trị
- Hóa trị là phương pháp sử dụng các thuốc hóa chất dạng uống, tiêm, truyền để điều trị bệnh ung thư. Các thuốc hóa chất là các tác nhân kìm chế sự phát triển của khối u bằng cách can thiệp vào sự nhân lên của tế bào ung thư. Hóa trị phải được xem xét dựa trên các nguyên tắc sau: lựa chọn thuốc thích hợp cho mỗi tình huống lâm sàng cụ thể, cần nắm vững được dược động học, cơ chế tác dụng, liều lượng, cách dùng, tác dụng không mong muốn của từng thuốc; đảm bảo đúng liều và liệu trình điều trị; kết hợp các hóa chất có cơ chế tác dụng khác nhau. Cần theo dõi sát bệnh nhân trong và sau quá trình dùng hóa chất để phát hiện và xử lý kịp thời các tác dụng không mong muốn.
- Các phương pháp hóa trị
- Hóa trị bổ trợ trước hay hóa trị tân bổ trợ: là phương pháp điều trị hóa trị trước một phương pháp điều trị chính khác, với mục đích làm giảm kích thước u, giảm giai đoạn bệnh.
- Hóa trị bổ trợ: là sử dụng hóa chất sau khi đã điều trị triệt căn bằng các phương pháp điều trị khác (phẫu thuật, xạ trị). Hóa trị bổ trợ nhằm mục đích tiêu diệt các ổ vi di căn, làm giảm nguy cơ tái phát, tăng thời gian sống của bệnh nhân. Phác đồ hóa trị có thể kết hợp với các thuốc điều trị đích (trastuzumab, bevacizumab...).
- Hóa trị điều trị bệnh ở giai đoạn di căn, lan tràn: nhằm mục đích giảm nhẹ triệu chứng và cải thiện chất lượng sống cho bệnh nhân. Hóa chất toàn thân hoặc tại chỗ: bơm hóa chất vào màng phổi hoặc màng bụng nhằm giảm tràn dịch màng phổi, màng bụng; nếu thể trạng bệnh nhân cho phép, xem xét khả năng hóa trị toàn thân.
- Có nhiều nhóm thuốc hóa chất khác nhau, với các cơ chế tác động khác nhau vào chu trình tế bào, các thuốc hóa chất dùng đường toàn thân tiêu diệt tế bào ung thư đồng thời cũng ảnh hưởng đến các cơ quan lành, tuy nhiên các cơ quan lành sẽ hồi phục sau mỗi chu kỳ hóa trị.
- Có nhiều phác đồ hóa trị khác nhau, các phác đồ này đều nhằm mục đích tiêu diệt các tế bào ung thư và giảm thiểu tác dụng không mong muốn đến các tế bào lành. Tùy từng loại bệnh ung thư, loại mô bệnh học, thể trạng người bệnh... mà bác sĩ sẽ lựa chọn phác đồ phù hợp cho người bệnh.
- Ngoài hóa trị chuẩn thì hóa trị metronomic (sử dụng thuốc liều thấp thường xuyên trong thời gian dài mà không ngắt quãng) mang lại lợi ích rất tốt cho các bệnh nhân không phù hợp với hóa trị chuẩn.
- Điều trị đích
+ Điều trị đích là dùng các chất để ngăn chặn sự phát triển của tế bào ung thư bằng cách tác động vào các phân tử đặc hiệu (các đích phân tử - molecular targets), cần thiết cho quá trình sinh ung thư và phát triển khối u. Điều trị đích có thể tác động vào các thụ thể nằm trên màng tế bào hoặc trong màng tế bào.
+ Có nhiều cách phân loại thuốc điều trị đích nhưng cách phân loại theo cơ chế tác động vào thụ thể bên ngoài và bên trong màng tế bào hay được sử dụng nhất. Với cách phân loại này, thuốc điều trị đích được chia làm hai loại kháng thể đơn dòng và thuốc có phân tử nhỏ.
- Các kháng thể đơn dòng (monoclonal antibody), tên gọi thường có đuôi là -mab, là kháng thể chỉ gắn với một loại kháng nguyên đặc hiệu ngoài màng tế bào (các kháng nguyên này thường đóng vai trò quan trọng dẫn truyền tín hiệu giúp khối u phát triển).
- Các thuốc loại phân tử nhỏ (small molecule inhibitor), tên gọi thường có đuôi là - ib, đa số là các chất ức chế kinase, tác động vào các con đường tín hiệu bên trong tế bào. Chỉ định điều trị đích tùy thuộc loại bệnh ung thư, giai đoạn bệnh, các xét nghiệm sinh học phân tử (gen), mô bệnh học (hóa mô miễn dịch).
- Điều trị nội tiết
- Đây là phương pháp điều trị được áp dụng từ nhiều năm nay, là tiền thân của phương pháp điều trị đích. Phương pháp điều trị nội tiết có nhiều ưu điểm như: đơn giản, dễ thực hiện, ít tác dụng phụ so với các phương pháp điều trị khác. Một số bệnh ung thư được điều trị nội tiết hiện nay: ung thư vú, ung thư tuyến tiền liệt...
- Điều trị miễn dịch
- Điều trị miễn dịch (miễn dịch trị liệu) có thể được hiểu là phương pháp sử dụng một trong các thành phần của hệ thống miễn dịch của bệnh nhân để chống lại bệnh tật trong đó có bệnh ung thư. Phương pháp này được thực hiện theo hai cách chính: kích thích hệ thống miễn dịch làm việc “nhiều hơn” và “thông minh hơn” để tấn công lại các tế bào ung thư và bổ sung cho bệnh nhân thành phần trong hệ miễn dịch như tế bào miễn dịch, kháng thể.
- Trong cơ thể bình thường, CTLA-4 và PD-1 là các điểm ức chế giúp tế bào T không tấn công các tế bào bình thường. Tuy nhiên, tế bào ung thư lại tạo ra các protein có khả năng gắn với “điểm ức chế” CTLA-4 và PD-1, làm cho tế bào T bị tê liệt, giúp các tế bào ung thư trốn thoát khỏi sự kiểm soát của hệ thống miễn dịch. Các nghiên cứu đã mở ra một hướng mới trong điều trị ung thư là sử dụng kháng thể đơn dòng giúp giải phóng các “điểm ức chế” CTLA-4 và PD-1, từ đó tế bào T có thể tiêu diệt các tế bào ung thư.
- Ngoài ra, CAR-T (Chimeric Antigen Receptor T-cell) tế bào lympho T chứa thụ thể kháng nguyên dạng khảm cũng là một trong những phương pháp điều trị miễn dịch. Thụ thể là một phân tử protein nằm trên màng hay trong tế bào, nhận tín hiệu hoá học từ bên ngoài vào trong tế bào, tương tự vai trò “cánh tay” hay “đôi mắt” của tế bào lympho T. Kháng nguyên là một phân tử kích thích đáp ứng miễn dịch của cơ thể. Dạng khảm là dạng được lai từ ít nhất hai cá thể khác nhau. CAR-T là dựa vào hệ miễn dịch để chống lại ung thư bằng cách nâng cao khả năng phát hiện và diệt trừ tế bào ung thư của những tế bào hệ miễn dịch. Các tế bào ung thư giả dạng là tế bào lành (bình thường) nên các tế bào T bỏ sót, không nhận diện được tế bào lạ cần tiêu diệt, từ đó các tế bào ung thư phát triển, tăng sinh hình thành khối u và di căn. Phương pháp CAR-T sẽ tạo lại sự nhận diện tế bào ung thư cho tế bào T, từ đó tế bào miễn dịch của cơ thể nhận biết và tiêu diệt tế bào ung thư. Như vậy, phương pháp điều trị miễn dịch tác động gián tiếp, tăng cường khả năng của hệ thống miễn dịch, giúp tiêu diệt khối u. Hiện nay, điều trị miễn dịch đã được thực hiện có hiệu quả cho nhiều bệnh ung thư như: ung thư phổi không tế bào nhỏ, ung thư đầu mặt cổ, ung thư dạ dày, ung thư hắc tố, ung thư cổ tử cung, u lympho, ung thư đường niệu, bệnh bạch cầu...
- Tuy nhiên, hiện vẫn cần nhiều nghiên cứu để đánh giá hiệu quả và tác dụng không mong muốn của các thuốc thế hệ mới (đích, miễn dịch) trong điều trị bệnh ung thư.
2. Các bệnh ung thư cụ thể
Trong khuôn khổ cuốn sách này chúng tôi đề cập đến năm bệnh ung thư có tần suất mắc nhiều nhất tại Việt Nam là: ung thư gan, ung thư phổi, ung thư đại trực tràng, ung thư vú, ung thư dạ dày.
2.1. Bệnh ung thư gan
Ung thư gan nguyên phát hay ung thư biểu mô tế bào gan là bệnh lý ác tính của tế bào gan, bệnh có tỷ lệ mắc và tỷ lệ tử vong cao ở các nước Đông Á. Theo Globocan năm 2018 trên thế giới, ung thư gan đứng thứ 7 về tỷ lệ mắc với 841.080 trường hợp nhưng lại đứng thứ 5 về tỷ lệ tử vong với 782.000 (8,2% các nguyên nhân tử vong do ung thư). Tại Việt Nam, ung thư gan là bệnh phổ biến, tỷ lệ mắc ung thư gan tính chung cho cả hai giới đứng hàng số 1 với 25.335 trường hợp mỗi năm, chiếm 16,45% các loại bệnh ung thư. Bệnh thường chẩn đoán ở giai đoạn muộn nên tiên lượng xấu, hằng năm có 25.000 trường hợp ung thư gan tử vong và chiếm 23,48% trường hợp tử vong do ung thư.
Bệnh ung thư gan hay gặp trên đối tượng nguy cơ cao đó là xơ gan do virus (viêm gan B hoặc viêm gan C hoặc cả hai), xơ gan do rượu, nhiễm độc. Vì vậy, điều trị ung thư gan cần bao gồm cả điều trị ung thư và điều trị xơ gan, viêm gan B, C kèm theo điều trị các triệu chứng của bệnh.
2.1.1 Tính chất của bệnh ung thư
- Bệnh ung thư gan thường có tiến triển âm thầm, chỉ một số trường hợp phát hiện sớm được bệnh nhờ khám sức khỏe định kỳ, đặc biệt trên ác đối tượng có nguy cơ cao như đã nêu ở trên. Hầu hết các trường hợp khác khi có biểu hiện lâm sàng: mệt mỏi, chán ăn, đau tức hạ sườn phải thì khối u tại gan kích thước đã trên 5cm, thậm chí một số trường hợp đã ở giai đoạn muộn: vàng da, vàng mắt, mệt mỏi, suy kiệt, cổ trướng, phù hai chi dưới. Người bệnh ung thư gan ở giai đoạn muộn ngoài các biểu hiện lâm sàng nêu trên thì các xét nghiệm máu cũng có nhiều bất thường như: suy gan, suy thận, rối loạn đông máu, giảm albumin trong máu, tăng bilirubin, ALT, AST,...
- Để sàng lọc phát hiện sớm bệnh cần xét nghiệm bộ ba AFP (alpha-fetoprotein), AFP-L3, PIVKA II phối hợp với siêu âm ổ bụng (chụp cắt lớp vi tính hoặc cộng hưởng từ ổ bụng trong các trường hợp nghi ngờ tổn thương).
2.1.2 Chẩn đoán:
- Chẩn đoán bệnh dựa vào các đặc điểm lâm sàng và cận lâm sàng.
- Triệu chứng lâm sàng:
- Triệu chứng cơ năng: bệnh diễn biến âm thầm không có triệu chứng, nhiều khi phát hiện do tình cờ siêu âm, khám sức khỏe định kỳ. Triệu chứng cơ năng có thể gặp: đầy bụng, khó tiêu, tức hoặc đau âm ỉ vùng hạ sườn phải, mệt mỏi, ăn uống kém, sút cân, ngứa, vàng da, vàng mắt, bụng to do có dịch ổ bụng.
- Triệu chứng thực thể: có thể gặp gan to, lách to, sao mạch, tuần hoàn bàng hệ, giãn tĩnh mạch, chảy máu, suy kiệt, cổ trướng, phù mềm, da niêm mạc vàng.
- Xét nghiệm cận lâm sàng
- Công thức máu: có thể giảm tiểu cầu, số lượng tiểu cầu dưới 100 g/L do xơ gan và/hoặc giảm hemoglobin có thể liên quan đến chảy máu.
- Sinh hóa máu: có thể giảm natri, tăng creatinin, tăng men gan, tăng bilirubin, tăng canxi máu, giảm albumin, giảm glucose.
- Đông máu: kéo dài PT/INR, thời gian prothrombin giảm.
- Virus: xét nghiệm HBsAg/anti-HBc, anti-HCV, định lượng HBV-DNA...đánh giá tình trạng nhiễm và tải lượng virus viêm gan B, C.
- Xét nghiệm bộ ba dấu ấn ung thư (chất chỉ điểm khối u): AFP, AFP-L3, PIVKA II.
- Siêu âm, chụp CT, MRI gan, ổ bụng: xác định số lượng, vị trí, kích thước u gan, tính chất xâm lấn, huyết khối tĩnh mạch cửa. Chụp xạ hình xương, PET/CT, chụp CT ngực, MRI sọ não... phát hiện các tổn thương di căn.
- Sinh thiết u gan dưới hướng dẫn của siêu âm hoặc cắt lớp vi tính để xét nghiệm mô bệnh học xác định chẩn đoán khi cần.
- Giải trình tự nhiều gen.
- Tiêu chuẩn chẩn đoán xác định:
+ Chẩn đoán xác định khi có một trong ba tiêu chuẩn sau:
- Có bằng chứng mô bệnh học là ung thư tế bào gan nguyên phát.
- Có hình ảnh điển hình* trên chụp cắt lớp vi tính ổ bụng có cản quang hoặc cộng hưởng từ bụng có cản từ và AFP ≥ 400 ng/mL.
- Có hình ảnh điển hình* trên chụp cắt lớp vi tính ổ bụng có cản quang hoặc cộng hưởng từ bụng có cản từ và AFP tăng cao nhưng chưa đến 400 ng/mL và có nhiễm virus viêm gan B hoặc C. Có thể làm sinh thiết gan để chẩn đoán xác định nếu bác sĩ lâm sàng thấy cần thiết.
+ Các trường hợp không đủ các tiêu chuẩn nói trên đều phải làm sinh thiết gan để chẩn đoán xác định.
* Hình ảnh điển hình trên chụp cắt lớp vi tính ổ bụng có cản quang hoặc cộng hưởng từ bụng có cản từ: khối u tăng quang trên thì động mạch gan và thoát thuốc (wash out) trên thì tĩnh mạch cửa hay thì chậm, hoặc khối u giảm quang trên thì chưa tiêm cản quang và tăng quang trên thì động mạch gan.
- Chẩn đoán giai đoạn bệnh
+ Có nhiều phân loại đánh giá giai đoạn bệnh ung thư gan, trong đó phân loại giai đoạn TNM của Hiệp hội Ung thư Hoa Kỳ (American Joint Committee on Cancer-AJCC) và phân loại theo Barcelona hay được sử dụng hơn cả.
+ Phân loại giai đoạn TNM theo AJCC năm 2017.
T : Khối u nguyên phát
- Tx: không đánh giá được khối u nguyên phát
- T0: không có bằng chứng của u nguyên phát
- T1: khối u ≤ 2 cm hoặc > 2 cm không xâm lấn mạch máu.
- T1a: khối u ≤ 2 cm.
- T1b: khối u > 2 cm không xâm lấn mạch máu.
- T2: khối u > 2 cm có xâm lấn mạch máu hoặc nhiều khối u nhưng kích thước ≤ 5 cm.
- T3: nhiều khối u, ít nhất 1 khối > 5 cm.
- T4: một khối hoặc nhiều khối u kích thước bất kỳ nhưng đã xâm lấn đến nhánh chính của tĩnh mạch cửa hoặc tĩnh mạch gan, hoặc khối u xâm lấn trực tiếp đến cơ quan lân cận khác ngoài túi mật hoặc thủng phúc mạc tạng.
N: Hạch vùng
- N0: không có di căn hạch.
- N1: di căn hạch.
M: Di căn xa
- M0: không có di căn xa.
- M1: có di căn xa.
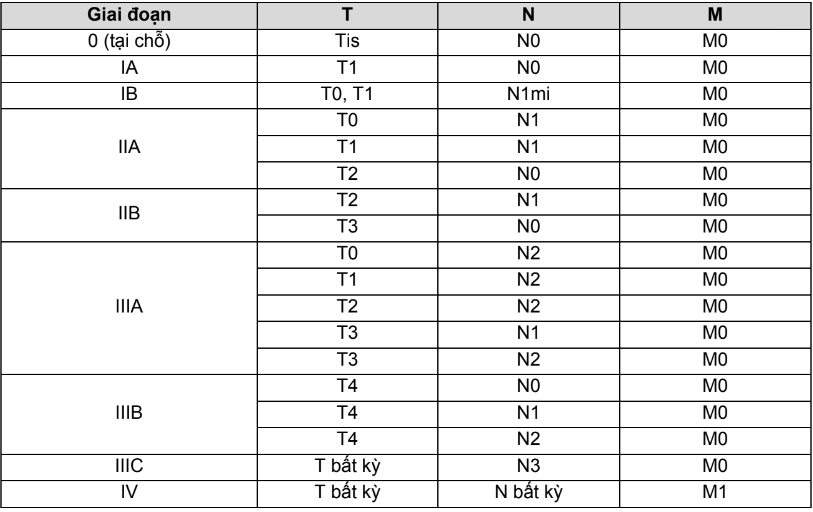
Bảng 4.1. Phân loại giai đoạn theo TNM bệnh ung thư gan
| Giai đoạn | T | N | M |
| IA | T1a | N0 | M0 |
| IB | T1b | N0 | M0 |
| II | T2 | N0 | M0 |
| IIIA | T3 | N0 | M0 |
| IIIB | T4 | N0 | M0 |
| IVA | bất kỳ T | N1 | M0 |
| IVB | bất kỳ T | bất kỳ N | M1 |
Bảng 4.2. Phân loại giai đoạn bệnh ung thư gan theo phân loại Barcelona
| Giai đoạn | PS | Tình trạng u |
Chức năng gan (Child-Pugh) |
| 0 (rất sớm) | 0 | Một u đơn độc < 2 cm | A |
| A (sớm) | 0 |
Một u đơn độc ≤ 5 cm hoặc ≤ 3 u, mỗi u ≤ 3 cm |
A-B |
| B (trung gian) | 0 | U lớn, nhiều u | A-B |
| C (tiến triển) | 1-2 |
U mọi kích thước, huyết khối tĩnh mạch cửa hoặc di căn ngoài gan |
A-B |
| D (cuối) | 3-4 | Bất kỳ | C |
PS: Performance Status: chỉ số toàn trạng theo ECOG (Eastern Cooperative Oncology Group)
+ Hệ thống điểm Child-Pugh đánh giá chức năng gan:
Bảng 4.3. Đánh giá chức năng gan theo hệ thống điểm Child-Pugh
| Thông số | 1 điểm | 2 điểm | 3 điểm |
| Bilirubin huyết thanh (mg/dL) | < 2 | 2 - 3 | > 3 |
| Albumin huyết thanh (g/dL) | > 3,5 | 2,8 - 3,5 | < 2,8 |
| INR | < 1,70 | 1,71 - 2,2 | > 2,2 |
| Dịch ổ bụng | Không | Kiểm soát được bằng thuốc | Khó kiểm soát |
| Bệnh lý não gan | Không | Kiểm soát được bằng thuốc | Khó kiểm soát |
| Tổng số điểm | Phân loại Child-Pugh |
| 5 – 6 | A (xơ gan còn bù) |
| 7 – 9 | B (xơ gan mất bù) |
| 10 – 15 | C (xơ gan mất bù) |
+ Chỉ số đánh giá hoạt động cơ thể (Eastern Cooperative Oncology Group - ECOG):
- ECOG mức 0: không triệu chứng, hoạt động bình thường.
- ECOG mức 1: có triệu chứng nhưng vẫn đi lại tương đối bình thường.
- ECOG mức 2: có triệu chứng, nằm giường bệnh < 50% thời gian trong ngày.
- ECOG mức 3: có triệu chứng, nằm giường bệnh > 50% thời gian trong ngày.
- ECOG mức 4: nằm liệt giường.
2.1.3. Điều trị
- Các phương pháp điều trị bệnh ung thư gan bao gồm:
- Điều trị tại chỗ: phẫu thuật, đốt sóng cao tần, nút mạch, xạ trị trong chọn lọc với Y- 90, vi sóng, áp lạnh, bơm hóa chất động mạch.
- Điều trị toàn thân: hóa chất, điều trị đích, miễn dịch. Tùy thuộc vào kích thước khối u, vị trí khối u gan, huyết khối tĩnh mạch cửa, chức năng gan, thể trạng người bệnh, tình trạng di căn xa... mà sẽ áp dụng một hoặc phối hợp các phương pháp điều trị nêu trên.
- Song song với việc điều trị ung thư gan thì cần điều trị nguyên nhân gây bệnh ung thư gan và các biến chứng của bệnh; bao gồm điều trị viêm gan B, C, điều trị xơ gan, nâng cao thể trạng, giảm đau, tăng cường miễn dịch, chọc tháo dịch ổ bụng...
- Việc lựa chọn các loại thuốc điều trị cần phải dựa vào thể trạng người bệnh, các bệnh lý phối hợp, các triệu chứng của bệnh, chức năng gan, thận, tủy xương. Ví dụ: với các bệnh nhân ung thư gan, có tình trạng rối loạn chức năng đông máu (tiểu cầu và/hoặc tỷ lệ prothrombin thấp) thì cần phải lưu ý đến tình trạng tăng áp lực tĩnh mạch cửa, tình trạng chảy máu có thể xảy ra khi sử dụng một số thuốc để từ đó có sự cân nhắc và lựa chọn thuốc phù hợp.
- Điều trị tại chỗ:
- Phẫu thuật cắt bỏ phân thùy gan, phần gan có mang khối u: áp dụng ở bệnh nhân có thể trạng chung tốt PS: 0-1, phần gan có khối u dự kiến cắt bỏ được. Thể tích gan dự kiến còn lại ≥ 50% thể tích gan ban đầu, giai đoạn Child Pugh A, B, không có di căn xa, không có tăng áp lực tĩnh mạch cửa.
- Phẫu thuật ghép gan: được chỉ định khi có một khối u gan kích thước khối u gan không quá 5 cm, hoặc không quá ba u, kích thước mỗi u không quá 3 cm, Child Pugh B, C, không có di căn xa, không có tăng áp lực tĩnh mạch cửa, không có khả năng phẫu thuật cắt bỏ phần gan, phân thùy gan chứa u.
- Phá hủy u tại chỗ bằng bằng vi sóng (microwave), bằng điện đông (cryotherapy): được chỉ định khi khối u gan có số lượng u ≤ 3 và kích thước u ≤ 3 cm, hoặc một u ≤ 5 cm, dễ tiếp cận, thể trạng chung còn tốt, PS 0-2, Child Pugh A, B, khối u không có khả năng cắt bỏ, không có di căn xa, không có tăng áp lực tĩnh mạch cửa, có bệnh lý đi kèm.
- Tiêm cồn tuyệt đối qua da (Percutaneous Ethanol Injection - PEI): chỉ định khi số lượng u ≤ 3 và kích thước u ≤ 3 cm, hoặc một u ≤ 5 cm, dễ tiếp cận. Những trường hợp chỉ định phá hủy khối u kích thước > 5 cm cần được hội chẩn, thể trạng chung còn tốt PS 0-2, Child Pugh A, B, khối u không có khả năng cắt bỏ, không có di căn xa, không có tăng áp lực tĩnh mạch cửa, có bệnh lý đi kèm, khối u ở vị trí không quá sâu, không gần mạch máu lớn trong gan.
- Cắt nguồn máu nuôi khối u phối hợp với diệt tế bào ung thư bằng hóa chất (Transcatheter Arterial Chemoembolization - TACE). Số lượng u ≤ 3 và kích thước u ≤ 3 cm, hoặc một u ≤ 5 cm, thể trạng chung còn tốt PS 0-2, Child Pugh A, B, khối u không cắt được, không có di căn, không có tăng áp lực tĩnh mạch cửa hoặc có nhiều u ở cả hai thùy (có thể có huyết khối tĩnh mạch cửa nhánh nhỏ).
- Xạ trị trong chọn lọc (Selective Internal Radio Therapy - SIRT): được chỉ định điều trị cho các bệnh nhân ung thư biểu mô tế bào gan không thể phẫu thuật, tái phát sau các phương pháp điều trị khác hoặc đã có huyết khối thân tĩnh mạch cửa, u xâm lấn mạch máu gan, Child Pugh A, Shunt lưu thông hoạt độ phóng xạ lên phổi < 20%.
- Xạ trị chiếu ngoài, xạ trị định vị thân vào gan: được chỉ định khi tổn thương tại gan mà không có chỉ định phẫu thuật, đốt sóng cao tần, vi sóng, nút mạch, xạ trị trong chọn lọc, Child Pugh B.
- Điều trị toàn thân:
Các thuốc điều trị bệnh ung thư gan bao gồm: hóa chất (gemcitabin, oxaliplatin, 5FU, doxorubicin, epirubicin, cisplatin, capecitabin, thalidomid...); thuốc điều trị đích (sorafenib, lenvatinib, regorafenib, cabozantinib...); thuốc điều trị miễn dịch (nivolumab, ramucirumab, pembrolizumab...). Điều trị đích, miễn dịch: được áp dụng ở giai đoạn tiến triển, di căn:
- Điều trị bước 1 hay sử dụng: sorafenib hoặc lenvatinib.
- Điều trị bước 2 hay sử dụng: sorafenib (sau thất bại bước 1 với lenvatinib) regorafenib (sau thất bại bước 1 với sorafenib), nivolumab, ramucirumab, pembrolizumab.
- Một số phác đồ hóa chất:
+ Phác đồ PIAF:
- Doxorubicin: 40 mg/m2, truyền tĩnh mạch ngày 1.
- Cisplatin: 20 mg/m2, truyền tĩnh mạch ngày 1, 2, 3, 4.
- 5-FU: 400 mg/m2, truyền tĩnh mạch ngày 1, 2, 3, 4.
- Interferon α-2a: Tiêm dưới da 5 MUI/m2, ngày 1, 2, 3, 4.
- Chu kỳ 3 tuần.
+ Phác đồ GEMOX:
- Gemcitabin 1.000 mg/m2, truyền tĩnh mạch ngày 1.
- Oxaliplatin 100 mg/m2, truyền tĩnh mạch ngày 2.
- Chu kỳ 2 tuần.
+ Phác đồ FOLFOX4:
- Folinic acid 200 mg/m2, truyền tĩnh mạch ngày 1
- Oxaliplatin 85 mg/m2, truyền tĩnh mạch ngày 1
- 5-FU 400 mg/m2, tiêm/truyền tĩnh mạch bolus ngày 1
- 5-FU 600 mg/m2truyền tĩnh mạch trong 22 giờ, ngày 1,2.
- Chu kỳ 2 tuần.
+ Phác đồ thalidomid
- Thalidomid 100 mg, uống 2 lần/ngày cho tới khi bệnh tiến triển hoặc xuất hiện các độc tính không chấp nhận được.
+ Phác đồ doxorubicin
- Doxorubicin: 20-30 mg/m2, truyền tĩnh mạch hàng tuần.
+ Phác đồ cisplatin
- Cisplatin: 80 mg/m2, truyền tĩnh mạch hàng tuần.
+ Phác đồ capecitabin
- Capecitabin: 1.000 mg/m2, uống ngày 2 lần, từ ngày 1-14, chu kỳ 21 ngày.
- Một số phác đồ điều trị đích, miễn dịch
- Sorafenib: 200 mg x 2 viên/lần, uống 2 lần/ngày cho tới khi bệnh tiến triển. Liều có thể giảm xuống 400 mg hàng ngày hoặc 400 mg cách ngày nếu bệnh nhân xuất hiện nhiều độc tính.
- Lenvatinib: 12 mg/ngày, uống hàng ngày (bệnh nhân trên 60 kg), 8 mg/ngày, uống hàng ngày (bệnh nhân dưới 60 kg).
- Regorafenib: 160 mg/ngày, uống ngày 1-21, chu kỳ 28 ngày.
- Nivolumab: 3 mg/kg, truyền tĩnh mạch chu kỳ 2 tuần.
- Cabozantinib: 60 mg/ngày, uống hàng ngày.
- Ramucirumab: 8 mg/kg, truyền tĩnh mạch chu kỳ 2 tuần.
- Pembrolizumab: 200 mg, truyền tĩnh mạch chu kỳ 3 tuần.
- Điều trị phối hợp: thuốc điều trị viêm gan B, C; thuốc nâng cao thể trạng; thuốc tăng cường miễn dịch; thuốc giảm áp lực tĩnh mạch cửa; thuốc giảm đau, lợi tiểu; các thuốc điều trị các bệnh lý phối hợp.
2.2. Bệnh ung thư phổi
- Ung thư phổi nguyên phát là bệnh lý ác tính tại phổi, đây là bệnh có tỷ lệ mắc có xu hướng ngày càng gia tăng. Theo Globocan năm 2018, trên thế giới ung thư phổi đứng thứ 1 về tỷ lệ mắc với 2.093.876 trường hợp và cũng đứng thứ 1 về tỷ lệ tử vong với 1.761.007 (18,4% các nguyên nhân tử vong do ung thư). Tại Việt Nam, ung thư phổi là bệnh phổ biến, tỷ lệ mắc ung thư phổi tính chung cho cả hai giới đứng hàng số 2 với 23.667 trường hợp mỗi năm, chiếm 15,37% các loại bệnh ung thư. Hiện nay, người mắc bệnh ung thư phổi ở Việt Nam có xu hướng ngày càng được chẩn đoán sớm hơn, tuy nhiên tỷ lệ người bệnh được chẩn đoán ở giai đoạn muộn còn cao nên tiên lượng xấu, hằng năm có 20.710 trường hợp ung thư phổi tử vong và chiếm 19,14% trường hợp tử vong do ung thư.
- Bệnh ung thư phổi hay gặp trên đối tượng nguy cơ cao đó là nam giới trên 50 tuổi, người hút thuốc lá, thuốc lào, người có tiền sử tiếp xúc với các hóa chất độc hại, bụi Amiăng.
- Có 2 nhóm: ung thư phổi tế bào nhỏ và ung thư phổi không phải tế bào nhỏ; mỗi nhóm có tiên lượng và chiến lược điều trị khác nhau.
2.2.1. Tính chất của bệnh ung thư
Ung thư phổi ở giai đoạn sớm thường được phát hiện tình cờ hoặc qua thăm khám sức khỏe định kỳ. Ở giai đoạn sớm, bệnh tiến triển âm thầm, ít có các biểu hiện hoặc các biểu hiện không đặc hiệu (ho, đau ngực) dễ lẫn với các triệu chứng bệnh khác. Ở giai đoạn muộn, thường có các biểu hiện đau ngực, ho ra máu, ho kéo dài, khó thở và các biểu hiện do các tổn thương di căn xa (đau tại vùng di căn xương, đau đầu, nôn, yếu, liệt). Ở giai đoạn cuối, người bệnh thường suy kiệt, đau nhiều, khó thở.
2.2.2. Chẩn đoán
Dựa vào các triệu chứng lâm sàng và cận lâm sàng
- Triệu chứng lâm sàng: Triệu chứng cơ năng và thực thể:
- Ở giai đoạn sớm: bệnh phát triển âm thầm, triệu chứng thường nghèo nàn hoặc không có triệu chứng. Có thể có dấu hiệu gợi ý: ho khan kéo dài, có thể có đờm lẫn máu, điều trị kháng sinh không có kết quả.
- Ở giai đoạn tiến triển: triệu chứng đa dạng tùy theo vị trí u, mức độ lan rộng tổn thương. Có thể gặp: đau ngực, đau dai dẳng, cố định một vị trí; khó thở khi khối u to, chèn ép, bít tắc đường hô hấp; hội chứng trung thất; tràn dịch màng tim, rối loạn nhịp tim; tràn dịch màng phổi. Toàn thân: mệt mỏi, gầy sút, sốt.
- Các dấu hiệu do di căn: hạch thượng đòn; nốt di căn da thành ngực; di căn não: hội chứng tăng áp lực nội sọ, liệt thần kinh khu trú; di căn xương: đau, gãy xương bệnh lý. Di căn phổi đối bên, di căn gan: thường không có triệu chứng lâm sàng.
- Các hội chứng cận ung thư: thường gặp trong ung thư phổi tế bào nhỏ, gồm ngón tay dùi trống; đái tháo nhạt do khối u bài tiết chất giống ADH; hội chứng Cushing do khối u bài tiết chất giống ACTH; tăng canxi máu do khối u bài tiết chất giống PTH; vú to, giọng cao, teo tinh hoàn do khối u bài tiết chất giống gonadotropin; hội chứng giả nhược cơ; hội chứng da liễu-viêm da cơ...
- Xét nghiệm cận lâm sàng
- Tế bào học: tìm tế bào ung thư trong đờm, dịch màng phổi, dịch rửa phế quản. Nếu có hạch thượng đòn có thể xét nghiệm tế bào học bằng chọc hút kim nhỏ.
- Chụp X quang lồng ngực thẳng và nghiêng, chụp cắt lớp vi tính lồng ngực: giúp xác định vị trí, hình thái, kích thước tổn thương, mức độ lan rộng của u và tình trạng di căn phổi. Ngoài ra, còn để đánh giá khả năng phẫu thuật.
- Nội soi phế quản: giúp quan sát trực tiếp tổn thương, xác định vị trí, hình thái tổn thương. Qua nội soi tiến hành sinh thiết trực tiếp tổn thương hoặc xuyên thành phế quản để chẩn đoán mô bệnh học.
- Sinh thiết xuyên thành ngực dưới hướng dẫn chụp cắt lớp vi tính: có giá trị với các khối u ngoại vi gần thành ngực. Lấy bệnh phẩm, làm xét nghiệm mô bệnh học và sinh học phân tử.
- Xét nghiệm mô bệnh học, nhuộm hóa mô miễn dịch: là tiêu chuẩn vàng để chẩn đoán bệnh và phân loại mô bệnh học ung thư phổi tế bào nhỏ hoặc không phải tế bào nhỏ (biểu mô tuyến, tuyến-vảy, tế bào lớn...); đồng thời nhuộm hóa mô miễn dịch đánh giá loại tế bào và đánh giá sự bộc lộ PD-L1, ALK...
- Xét nghiệm sinh học phân tử nhằm phát hiện các đột biến gen: Gen EGFR, ALK, ROS-1, BRAF, KRAS, TMB (Tumor Mutational Burden), giải trình tự nhiều gen giúp cho việc lựa chọn các thuốc điều trị đích, miễn dịch.
- Siêu âm ổ bụng, chụp cắt lớp vi tính hoặc cộng hưởng từ sọ não, xạ hình xương, PET/CT... đánh giá giai đoạn bệnh.
- Chẩn đoán giai đoạn bệnh
Phân loại giai đoạn TNM theo The American Joint Committee on Cancer (AJCC) năm 2017.
T: U nguyên phát
+ Tx: không xác định được khối u, có tế bào ác tính trong đờm hoặc dịch rửa phế quản nhưng không nhìn thấy được trên chẩn đoán hình ảnh hay nội soi phế quản.
+ T0: không có bằng chứng về u nguyên phát.
+ Tis: ung thư biểu mô tại chỗ.
Ung thư biểu mô tế bào vảy tại chỗ.
Ung thư biểu mô tuyến tại chỗ: kích thước chỗ lớn nhất ≤ 3cm.
+ T1: kích thước lớn nhất của khối u ≤ 3cm, được bao quanh bởi nhu mô phổi hoặc lá tạng màng phổi, không có bằng chứng về xâm lấn vượt quá đoạn gần của phế quản thuỳ.
- T1mi: ung thư biểu mô tuyến xâm lấn tối thiểu.
- T1a: kích thước lớn nhất ≤ 1 cm. Trên bề mặt, khối u lan rộng về một số kích thước, xâm lấn giới hạn tới thành phế quản và có thể mở rộng ra phế quản chính nhưng được phân loại vào T1a, tuy nhiên không phổ biến.
- T1b: 1cm < kích thước lớn nhất ≤ 2cm.
- T1c: 2cm < kích thước chỗ lớn nhất ≤ 3cm.
+ T2: 3cm < kích thước lớn nhất ≤ 5cm hoặc bất kỳ nhưng: (1) xâm lấn phế quản gốc, cách ngã ba khí phế quản (carina) ≥ 2cm; (2) xâm lấn lá tạng màng phổi; (3) gây xẹp phổi hoặc viêm phổi tắc nghẽn lan đến rốn phổi nhưng chưa lan toàn bộ phổi. Gồm:
- T2a: 3cm < kích thước lớn nhất ≤ 4cm;
- T2b: 4cm < kích thước lớn nhất ≤ 5 cm.
+ T3: 5cm < kích thước lớn nhất ≤ 7 cm hoặc xâm lấn một trong các thành phần: thành ngực (bao gồm cả khối u rãnh liên thùy trên); thần kinh hoành; màng phổi trung thất; màng ngoài tim hoặc có các nốt riêng biệt trên cùng 1 thùy phổi.
+ T4: khối u ≥ 7cm hoặc u bất kỳ kích thước nhưng xâm lấn 1 trong các thành phần sau: cơ hoành trung thất, tim, mạch máu lớn, khí quản, thần kinh quặt ngược thanh quản, thực quản, thân đốt sống, carina, các nốt khối u khác ở thùy phổi khác cùng bên.
N: Hạch vùng
- Nx: không xác định được hạch vùng.
- N0: không có di căn hạch vùng.
- N1: di căn hạch cạnh phế quản và hoặc hạch trong phổi, hạch rốn phổi cùng bên, bao gồm cả sự xâm lấn trực tiếp.
- N2: di căn hạch trung thất cùng bên và hạch dưới carina.
- N3: di căn hạch rốn phổi đối bên, hạch trung thất đối bên, hạch cơ bậc thang cùng hoặc đối bên, hạch thượng đòn.
M: Di căn xa
- Mx: không xác định được di căn xa.
- M0: không có di căn xa.
- M1: di căn xa. Gồm M1a: có kèm theo các nốt khối u ở phổi đối bên, u ở màng phổi hoặc màng tim hoặc tràn dịch màng phổi hoặc màng tim ác tính; M1b: di căn ngoài ngực ở một cơ quan đơn thuần. M1c: di căn nhiều nơi ngoài ngực với chỉ một nốt ở một cơ quan hoặc trong nhiều cơ quan.
Bảng 4.4. Phân loại giai đoạn bệnh theo TNM bệnh ung thư phổi
| Giai đoạn | T | N | M |
| 0 | Tis | N0 | M0 |
| IA1 | T1mi, T1a | N0 | M0 |
| IA2 | T1b | N0 | M0 |
| IA3 | T1c | N0 | M0 |
| IB | T2a | N0 | M0 |
| IIA | T2b | N0 | M0 |
|
IIB |
T1a,1b,1c, T2a,2b | N1 | M0 |
| T3 | N0 | M0 | |
| IIIA | T1a,1b,1c, T2a,2b | N2 | M0 |
| T3 | N1 | M0 | |
| T4 | N0 | M0 | |
| T4 | N1 | M0 | |
| III B | T1a,1b,1c, T2a,2b | N3 | M0 |
| T3, T4 | N2 | M0 | |
| IIIC | T3, T4 | N3 | M0 |
| IVA | T bất kỳ | N bất kỳ | M1a,1b |
| IVB | T bất kỳ | N bất kỳ | M1c |
+ Ung thư phổi tế bào nhỏ ngoài cách phân loại TNM như trên trong thực hành lâm sàng được chia ra hai giai đoạn:
- Giai đoạn khu trú: khi bệnh còn giới hạn khu trú có thể bao phủ bởi một trường chiếu xạ. Thường đánh giá giới hạn ở 1/2 lồng ngực và hạch vùng kể cả hạch trung thất, hạch thượng đòn cùng bên. Bao gồm giai đoạn I-III (T bất kỳ N bất kỳ M0) loại trừ các trường hợp T3-4 mà khối u quá lan rộng hoặc có khối u hoặc hạch quá lớn vượt quá sự bao phủ một trường chiếu xạ.
- Giai đoạn lan tràn: khi bệnh vượt quá giới hạn các vùng trên. Bao gồm giai đoạn IV và các trường hợp T3-4 mà khối u quá lan rộng hoặc có khối u hoặc hạch quá lớn vượt quá sự bao phủ một trường chiếu xạ.
2.2.3. Điều trị
Điều trị bệnh ung thư phổi là điều trị đa mô thức nhằm đem lại hiệu quả điều trị tối ưu nhất. Tùy thuộc giai đoạn bệnh, thể trạng người bệnh, vị trí, kích thước khối u, loại mô bệnh học, xét nghiệm đột biến gen (EGFR, ALK, ROS-1,...) mà bác sĩ lựa chọn phương pháp điều trị phù hợp bao gồm: phẫu thuật (cắt thùy phổi, cắt thùy phổi và vét hạch, cắt toàn bộ một bên phổi, phẫu thuật lấy tổn thương di căn, sinh thiết tổn thương u, hạch,...) xạ trị tại u, tại hạch, tại tổn thương di căn (xương, não,...), hóa trị (các phác đồ hóa trị khác nhau tùy loại mô bệnh học ung thư biểu mô tế bào nhỏ hay không tế bào nhỏ, với thuốc hay sử dụng: cisplatin, carboplatin, paclitaxel, docetaxel, 5FU, capecitabin, pemetrexed, vinorelbin, gemcitabin, irinotecan, etoposid, topotecan, temozolomid, cyclophosphamid, doxorubicin, vincristin, bendamustin,...) đối với ung thư phổi không tế bào nhỏ ngoài hóa trị chuẩn thì hóa trị metronomic (sử dụng thuốc liều thấp thường xuyên trong thời gian dài mà không ngắt quãng) mang lại lợi ích rất tốt cho bệnh nhân không phù hợp với hóa trị chuẩn, điều trị đích (tùy thuộc xét nghiệm đột biến gen EGFR, ALK, ROS-1, BRAF,...; tùy loại mô bệnh học ung thư biểu mô tuyến hay vảy; thuốc hay sử dụng: erlotinib, gefitinib, afatinib, osimetinib, dacomitinib, alectinib, brigatinib, ceritinib, crizotinib, lorlatinib, trametinib, larotrectinib, vandetanib, cabozantinib, dabrafenib, bevacizumab...), điều trị miễn dịch (tùy thuộc xét nghiệm PD-L1, TMB,... thuốc hay sử dụng: atezolizumab, pembrolizumab, nivolumab, ramucirumab, ipilimumab...), điều trị triệu chứng giảm đau, dinh dưỡng, tâm lý.
2.2.3.1. Ung thư phổi không tế bào nhỏ:
- Phẫu thuật: chỉ định ở giai đoạn 0, I, II, IIIA. Có thể: phẫu thuật cắt phân thùy, cắt thùy phổi kèm theo vét hạch rốn thùy, cắt lá phổi kèm theo vét hạch rốn phổi và trung thất, có thể cắt một phần màng tim, thành ngực.
- Xạ trị: chỉ định xạ trị đơn thuần triệt căn cho giai đoạn I, II, IIIA có chống chỉ định hoặc bệnh nhân từ chối phẫu thuật, hóa chất. Xạ trị trước mổ: cho giai đoạn IIIB, kích thước u quá lớn để xét khả năng phẫu thuật sau đó. Xạ trị sau mổ: cho giai đoạn II, IIIA và các trường hợp phẫu thuật cắt bỏ không hoàn toàn để lại tổ chức ung thư sau phẫu thuật. Xạ trị triệu chứng: xạ trị giảm đau, xạ trị toàn não, xạ trị chống chèn ép.
- Hóa trị chỉ định cho giai đoạn IV, IIIB, IIIA. Giai đoạn IIB, IIA cần được cân nhắc. Thuốc hay sử dụng: nhóm platin (cisplatin, carboplatin); nhóm taxan (paclitaxel, docetaxel, gemcitabin, vinorelbin; pemetrexed - với nhóm không phải ung thư biểu mô vảy); mitomycin; ifosfamid; vinblastin; 5FU; capecitabin, tegafur + gimeracil + oteracil potassium (TS one), tegafur + uracil (Ufur, Mefuform)
- Điều trị đích:
+ Thuốc phân tử nhỏ:
Các thuốc nhóm TKI (tyrosin kinase inhibitor):
- Thế hệ 1: erlotinib, gefitinib, chỉ định: ung thư phổi không tế bào nhỏ, có đột biến EGFR dương tính đột biến nhạy cảm (thường đột biến trên exon 19, 21).
- Thế hệ 2: afatinib chỉ định trong ung thư phổi không tế bào nhỏ có đột biến EGFR dương tính, bao gồm các đột biến thường gặp như L858R, Del 19 và đột biến không thường gặp. Các trường hợp đã thất bại với TKI thế hệ 1 do gặp tác dụng phụ, không dung nạp hoặc không đáp ứng. Các trường hợp có đột biến gen EGFR dương tính nhưng có tăng men gan, có điều trị các thuốc chuyển hóa qua enzym CYP450 hoặc các thuốc điều trị kháng acid dạ dày vì afatinib có bằng chứng không tương tác với CYP450 và các thuốc kháng acid dạ dày. Ung thư phổi không tế bào nhỏ loại biểu mô vẩy sau thất bại với hóa chất phác đồ có platin. Dacomitinib, chỉ định trong ung thư phổi không tế bào nhỏ có đột biến EGFR dương tính, bao gồm các đột biến thường gặp như L858R, Del 19.
- Thế hệ 3: osimertinib chỉ định trong ung thư phổi không tế bào nhỏ có đột biến gen EGFR dương tính, bao gồm cả trường hợp có đột biến gen T790M. Ung thư phổi tế bào nhỏ sau thất bại với TKI thế hệ 1, 2.
Các thuốc ức chế ALK, ROS-1, BRAF:
- Crizotinib, chỉ định: ung thư phổi không tế bào nhỏ có ALK dương tính và hoặc ROS-1 dương tính.
- Alectinib, chỉ định: ung thư phổi không tế bào nhỏ có ALK dương tính; ung thư phổi không tế bào nhỏ sau thất bại với crizotinib.
- Ceritinib, chỉ định: ung thư phổi không tế bào nhỏ có ALK dương tính và hoặc ROS-1 dương tính; ung thư phổi không tế bào nhỏ sau thất bại với crizotinib, alectinib.
- Brigatinib, chỉ định: ung thư phổi không tế bào nhỏ có ALK dương tính sau thất bại với crizotinib.
- Dabrafenib, chỉ định: ung thư phổi không tế bào nhỏ giai đoạn di căn xa có đột biến gen BRAF V600E dương tính.
- Trametinib, chỉ định: ung thư phổi không tế bào nhỏ giai đoạn di căn xa có đột biến gen BRAF V600E dương tính.
- Kháng thể đơn dòng:
- Bevacizumab, chỉ định: ung thư phổi không tế bào nhỏ giai đoạn tiến triển loại không biểu mô vảy.
- Ramucirumab, chỉ định: ung thư phổi không tế bào nhỏ giai đoạn tiến triển sau thất bại với hóa chất phác đồ có platin (bước 2). Ung thư phổi không tế bào nhỏ giai đoạn tiến triển sau thất bại với các thuốc điều trị đích nhóm TKI.
- Điều trị miễn dịch:
- Pembrolizumab, chỉ định điều trị bước 1: ung thư phổi không tế bào nhỏ giai đoạn di căn xa có PD-L1 dương tính ≥ 50%. Điều trị bước 2: ung thư phổi không tế bào nhỏ giai đoạn di căn xa có PD-L1 dương tính ≥ 1%.
- Nivolumab, chỉ định: ung thư phổi không tế bào nhỏ giai đoạn di căn xa, sau thất bại với điều trị hóa chất phác đồ có platin.
- Atezolizumab, chỉ định: ung thư phổi không tế bào nhỏ giai đoạn di căn, ung thư phổi tế bào nhỏ.
- Durvalumab, chỉ định: ung thư phổi không tế bào nhỏ giai đoạn III, không phẫu thuật được mà bệnh không tiến triển sau ≥ 2 chu kỳ hóa xạ trị đồng thời phác đồ có platin.
- Trong thực hành lâm sàng: đối với ung thư phổi không tế bào nhỏ giai đoạn tiến triển (IIIB, IV) thì điều trị như sau:
- Nếu có đột biến EGFR không có đột biến T790M thì có thể dùng TKI thế hệ 1, 2, 3 (erlotinib, gefitinib, afatinib, dacomitinib, osimetinib), nếu bước 1 dùng erlotinib hoặc gefitinib hoặc afatinib hoặc dacomitinib thì sau khi tiến triển, bước 2 sẽ xét nghiệm lại EGFR nếu xuất hiện đột biến T790M thì chuyển sang dùng thế hệ 3 (osimetinib);
- Nếu có ALK dương tính: bước 1 dùng alectinib hoặc brigatinib hoặc ceritinib hoặc crizotinib; bước 2 có thể dùng alectinib hoặc brigatinib hoặc ceritinib hoặc lorlatinib;
- Nếu có ROS-1 dương tính: dùng ceritinib hoặc crizotinib. Đột biến gen BRAF dương tính có thể điều trị bằng dabrafenib/trametinib. Nếu NTRK dương tính: có thể điều trị bằng larotrectinib. Đối với những người bệnh không có điều kiện kinh tế để sử dụng các thuốc TKI thì hóa trị vẫn là lựa chọn cơ bản ở giai đoạn tiến triển, di căn.
- Một số phác đồ hóa chất bệnh ung thư phổi không tế bào nhỏ:
+ Phác đồ PC:
- Paclitaxel 175 mg/m2, truyền tĩnh mạch trong 3 giờ ngày 1.
- Carboplatin AUC 6, truyền tĩnh mạch ngày 1.
- Chu kỳ 3 tuần.
+ Phác đồ DC:
- Docetaxel 75 mg/m2, truyền tĩnh mạch, ngày 1.
- Carboplatin AUC 6, truyền tĩnh mạch ngày 1.
- Chu kỳ 3 tuần.
+ Phác đồ GC:
- Gemcitabin 1.000 mg/m2 truyền tĩnh mạch, ngày 1, 8.
- Vinorelbin 25 mg/m2, truyền tĩnh mạch ngày 1, 8.
- Chu kỳ 3 tuần
+ Phác đồ pemetrexed + platin:
- Pemetrexed 500 mg/m2, truyền tĩnh mạch ngày 1.
- Carboplatin AUC 6 hoặc cisplatin 75 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 3 tuần.
+ Phác đồ vinorelbin:
- Vinorelbin 25 mg/m2, truyền tĩnh mạch ngày 1, 8. Chu kỳ 3 tuần.
- Hoặc vinorelbin 60-80 mg/m2, uống hàng tuần.
- Hoặc vinorelbin uống 30-50 mg/ lần x 3 lần/tuần.
+ Phác đồ capecitabin:
- Capecitabin 1.000-1.250mg/m2/lần, uống 2 lần/ngày, ngày 1-14, chu kỳ 21 ngày
- Một số phác đồ điều trị đích, miễn dịch bệnh ung thư phổi không tế bào nhỏ
+ Các thuốc nhóm TKI (tyrosin kinase inhibitor):
- Erlotinib: 1 viên 150 mg/ngày, uống hàng ngày, trước ăn ít nhất 1 giờ và sau ăn ít nhất 2 giờ.
- Gefitinib: 1 viên 250 mg/ngày, uống hàng ngày, trước ăn ít nhất 1 giờ và sau ăn ít nhất 2 giờ.
- Afatinib: 40 mg/ngày, uống hàng ngày, trước ăn ít nhất 1 giờ và sau ăn ít nhất 2 giờ.
- Osimertinib: 80 mg/ngày, uống hàng ngày.
- Crizotinib: uống 2 viên 250 mg/ngày, chia 2 lần, trước ăn ít nhất 1 giờ và sau ăn ít nhất 2 giờ.
- Alectinib: 600 mg/ngày, uống 2 lần/ngày, uống hàng ngày.
- Ceritinib: 450 mg/ngày, uống hàng ngày.
- Brigatinib: 90mg/ngày, hàng ngày x 7 ngày. Nếu độc tính chấp nhận được thì tăng liều 180 mg/ngày, uống hàng ngày.
- Dabrafenib: dùng phối hợp với trametinib. Liều dùng: 120 mg/ngày, uống 2 lần/ngày, hàng ngày.
- Trametinib: dùng phối hợp với dabrafenib. Liều dùng: 2 mg/ngày, hàng ngày.
+ Các thuốc kháng thể đơn dòng
- Bevacizumab: 15 mg/ kg, truyền tĩnh mạch ngày 1, dùng đơn chất (điều trị duy trì) hoặc kết hợp với hóa chất.
Ramucirumab: dùng phối hợp với docetaxel.
Ramucirumab 10 mg/kg, truyền tĩnh mạch ngày 1.
Docetaxel 75 mg/m2 , truyền tĩnh mạch ngày 1. Chu kỳ 21 ngày.
- Pembrolizumab 200 mg, truyền tĩnh mạch mỗi 3 tuần, dùng đơn chất hoặc kết hợp hóa chất.
- Nivolumab 3 mg/kg, truyền tĩnh mạch mỗi 2 tuần.
- Atezolizumab 1.200 mg, truyền tĩnh mạch mỗi 3 tuần, dùng đơn chất hoặc phối hợp với hóa chất.
- Durvalumab 10 mg/kg, truyền tĩnh mạch ngày 1, trong 1 giờ. Chu kỳ 2 tuần.
2.2.3.2. Ung thư phổi tế bào nhỏ:
- Phẫu thuật (cắt thùy phổi + vét hạch trung thất): chỉ định ở giai đoạn I-IIA (T1-2N0M0). Sau phẫu thuật, nếu có di căn hạch lựa chọn hóa trị và xạ trị sau mổ; nếu không di căn hạch thì hóa trị.
- Xạ trị: xạ trị dự phòng di căn não, chỉ định ở giai đoạn IIB-IV có đáp ứng với điều trị toàn thân. Xạ trị vào ngực: chỉ định giai đoạn khu trú hoặc giai đoạn I-IIA (T1,2N0M0) kết hợp với hóa trị hoặc giai đoạn lan tràn khi đã đạt đáp ứng hoàn toàn hoặc một phần với hóa trị.
- Hóa trị: giai đoạn khu trú (phối hợp với xạ trị) hoặc giai đoạn lan tràn, tái phát.
- Thuốc hay sử dụng: toposide dạng truyền và uống; nhóm platin: cisplatin, carboplatin; irinotecan; cyclophosphamid; doxorubicin; vincristin; topotecan uống hoặc tĩnh mạch; paclitaxel; docetaxel; temozolomid; vinorelbin dạng truyền và uống; gemcitabin; ifosfamid; bendamustin.
- Điều trị miễn dịch: atezolizumab chỉ định trong ung thư phổi tế bào nhỏ giai đoạn lan tràn. Nivolumab chỉ định ung thư phổi tế bào nhỏ giai đoạn IV sau thất bại với điều trị phác đồ hóa chất có platin. Ipilinumab chỉ định ung thư phổi tế bào nhỏ giai đoạn IV sau thất bại với điều trị phác đồ hóa chất có platin. Pembrolizumab chỉ định ung thư phổi tế bào nhỏ giai đoạn lan tràn, sau thất bại với điều trị hóa chất, có PD-L1 dương tính (CPS ≥ 1).
- Một số phác đồ hóa chất bệnh ung thư phổi loại tế bào nhỏ:
+ Phác đồ EP:
- Cisplatin 75mg/m2, truyền tĩnh mạch ngày 1.
- Etoposid 100mg/m2, truyền tĩnh mạch ngày 1-3; chu kỳ 28 ngày. Hoặc
- Cisplatin 25mg/m2, truyền tĩnh mạch ngày 1-3
- Etoposid 100mg/m2, truyền tĩnh mạch ngày 1-3; chu kỳ 28 ngày.Hoặc
- Cisplatin 60mg/m2truyền tĩnh mạch ngày 1.
- Etoposid 120mg/m2, truyền tĩnh mạch ngày 1-3; chu kỳ 28 ngày.Hoặc
- Carboplatin AUC 5-6, truyền tĩnh mạch ngày 1.
- Etoposid 100mg/m2, truyền tĩnh mạch ngày 1-3; chu kỳ 28 ngày.
+ Phác đồ IC:
- Irinotecan 60mg/m2, truyền tĩnh mạch ngày 1, 8, 15.
- Cisplatin 60mg/m2, truyền tĩnh mạch ngày 1; chu kỳ 28 ngày. Hoặc
- Irinotecan 65mg/m2, truyền tĩnh mạch ngày 1, 8
- Cisplatin 30mg/m2, truyền tĩnh mạch ngày 1, 8; chu kỳ 28 ngày. Hoặc
- Irinotecan 50mg/m2, truyền tĩnh mạch ngày 1, 8, 15.
- Carboplatin AUC 5, truyền tĩnh mạch ngày 1; chu kỳ 28 ngày.
+ Phác đồ CAV:
- Cyclophosphamid 1.000mg/m2, truyền tĩnh mạch ngày 1.
- Doxorubicin 45mg/m2, truyền tĩnh mạch ngày 1.
- Vincristin 1,4mg/m2, truyền tĩnh mạch ngày 1; chu kỳ 21 ngày.
+ Phác đồ CAE:
- Cyclophosphamid 1000mg/m2, truyền tĩnh mạch ngày 1.
- Doxorubicin 45mg/m2, truyền tĩnh mạch ngày 1.
- Etoposid 80-100mg/m2, truyền tĩnh mạch ngày 1-3 hoặc ngày 1, 3, 5; chu kỳ 21 ngày.
+ Phác đồ CEV:
- Cyclophosphamid 1.000mg/m2, truyền tĩnh mạch ngày 1.
- Epirubicin 70mg/m2, truyền tĩnh mạch ngày 1.
- Vincristin 2mg/m2, truyền tĩnh mạch ngày 1; chu kỳ 21 ngày
+Phác đồ ICE:
- Ifosfamid 5.000mg/m2, truyền tĩnh mạch 24 giờ ngày 1 (dùng kèm với mesna)
- Carboplatin 300mg/m2, truyền tĩnh mạch ngày 1 trong 1 giờ
- Etoposid 120mg/m2, truyền tĩnh mạch ngày 1,2 và 240mg/m2, tĩnh mạch ngày 3
- Vincristin 1,0mg/m2, truyền tĩnh mạch ngày 15
- Chu kỳ 28 ngày
+ Phác đồ VIP:
- Etoposide 75mg/m2, truyền tĩnh mạch ngày 1-4
- Ifosfamid 1.200mg/m2, truyền tĩnh mạch ngày 1-4 (với mesna)
- Cisplatin 20mg/m2, truyền tĩnh mạch ngày 1-4
+ Phác đồ Topotecan + Cisplatin
- Topotecan 1,0mg/m2, truyền tĩnh mạch ngày 1-5
- Cisplatin 60mg/m2, truyền tĩnh mạch ngày 1
- Chu kỳ 21 ngày
+ Phác đồ: Topotecan 1,0-1,5 mg/m2, truyền tĩnh mạch ngày 1-5. Chu kỳ 21 ngày
- Hoặc Topotecan 2,3 mg/m2, uống ngày 1-5. Chu kỳ 21 ngày
+ Phác đồ: Irinotecan 300 mg/m2, truyền tĩnh mạch. Chu kỳ 21 ngày
- Hoặc Irinotecan 100 mg/m2, truyền tĩnh mạch hàng tuần
+ Phác đồ: Paclitaxel 175-250 mg/m2, truyền tĩnh mạch trong 24 giờ ngày 1, 8, 15
- Hoặc Paclitaxel 80 mg/m2, truyền tĩnh mạch hàng tuần x 6 tuần, sau đó nghỉ 2 tuần
+ Phác đồ: Docetaxel 100 mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 3 tuần
+ Phác đồ: Temozolomid 75 mg/m2, uống. Chu kỳ 4 tuần
+ Phác đồ: Vinorelbin 25-30 mg/m2, truyền tĩnh mạch ngày 1, hàng tuần
+ Phác đồ: Etoposid uống 50 mg/m2, uống. Chu kỳ 4-5 tuần
+ Phác đồ: Gemcitabin 1.000 mg/m2, truyền tĩnh mạch ngày 1, 8, 15. Chu kỳ 4 tuần
- Một số phác đồ điều trị đích, miễn dịch bệnh ung thư phổi loại tế bào nhỏ:
+ Atezolizumab 1.200 mg, truyền tĩnh mạch mỗi 3 tuần, dùng đơn thuần hoặc kết hợp hóa chất.
+ Nivolumab:
- Đơn chất: Nivolumab 3 mg/kg, truyền tĩnh mạch ngày 1. Chu kỳ 2 tuần.
- Phối hợp:
Nivolumab 1mg/kg, truyền tĩnh mạch ngày 1.
Ipilimumab 3mg/kg, truyền tĩnh mạch ngày 1.
Chu kỳ 3 tuần x 4 chu kỳ. Sau đó, nivolumab 3mg/kg, truyền tĩnh mạch ngày 1. Chu kỳ 2 tuần.
Hoặc
- Nivolumab 3mg/kg, truyền tĩnh mạch ngày 1
- Ipilimumab 1mg/kg, truyền tĩnh mạch ngày 1
- Chu kỳ 3 tuần x 4 chu kỳ. Sau đó, nivolumab 3mg/kg, truyền tĩnh mạch ngày 1. Chu kỳ 2 tuần.
- Ipilinumab: dùng phối hợp với nivolumab theo phác đồ như trên.
- Pembrolizumab: pembrolizumab 200mg, truyền tĩnh mạch ngày 1. Chu kỳ 3 tuần.
2.3. Bệnh ung thư đại trực tràng
Ung thư đại trực tràng là bệnh lý ác tính tại đại trực tràng, đây loại ung thư thường gặp của đường tiêu hóa. Theo Globocan năm 2018, trên thế giới ung thư đại tràng đứng thứ 4 về tỷ lệ mắc với 1.096.601 trường hợp và số trường hợp tử vong là 551.269 (5,8% các nguyên nhân tử vong do ung thư). Ung thư trực tràng có tỷ lệ mắc thấp hơn với 704.376 trường hợp và 310.394 trường hợp tử vong. Tại Việt Nam, ung thư đại trực tràng là bệnh phổ biến, tỷ lệ mắc tính chung cho cả hai giới đứng hàng số 5 với 14.733 trường hợp mỗi năm, chiếm 8,9% các loại bệnh ung thư.
Những đối tượng nguy cơ cao mắc bệnh: người trong gia đình mắc bệnh ung thư đại trực tràng, bệnh Crohn, bệnh đa polyp đại trực tràng gia đình, người có chế độ ăn ít rau, nhiều chất béo, bệnh lý đại trực tràng: viêm loét mạn tính, polyp.
2.3.1 Tính chất của bệnh ung thư:
Bệnh ung thư đại trực tràng ở giai đoạn sớm thường phát hiện tình cờ qua nội soi đại trực tràng khi khám sức khỏe định kỳ. Ở giai đoạn tiếp theo, người bệnh thường có biểu hiện đau bụng, rối loạn tiêu hóa (đi ngoài phân lỏng hoặc táo bón và/hoặc đi ngoài phân nhầy máu mũi, thay đổi khuôn phân, mót rặn); ở giai đoạn muộn hơn, người bệnh có biểu hiện rối loạn tiêu hóa, tự sờ thấy khối ở bụng, đau bụng kèm theo biểu hiện tại các tổn thương di căn: đau tức hạ sườn phải, vàng da (di căn gan), ho, đau ngực (di căn phổi), đau xương (di căn xương), đau đầu, nôn, yếu liệt (di căn não), gầy sút cân, suy kiệt, tắc ruột (đau bụng từng cơn, bí đại tiện, nôn), thủng vỡ u tại đại trực tràng (đau bụng dữ dội, bụng cứng,...).
2.3.2. Chẩn đoán:
- Dựa vào triệu chứng lâm sàng và cận lâm sàng.
+ Triệu chứng lâm sàng
- Triệu chứng cơ năng: tuỳ vị trí u, giai đoạn bệnh mà có bệnh cảnh lâm sàng khác nhau. Nhìn chung có các dấu hiệu sau: đầy bụng, đau bụng, chậm tiêu, rối loạn tiêu hóa, đi ngoài phân nhầy máu mũi; hay gặp ở người bệnh ung thư trực tràng; tự sờ thấy khối u bụng vùng hạ vị, mạng sườn... Ngoài ra, có thể gặp bệnh nhân vào viện do xuất hiện biến chứng như: tắc ruột, viêm phúc mạc do vỡ u: bệnh cảnh lâm sàng rất nặng, tiên lượng xấu.
- Người bệnh vào viện khi bệnh ở giai đoạn muộn, triệu chứng tùy thuộc vào cơ quan di căn: cổ trướng số lượng từ ít đến nhiều do di căn phúc mạc; vàng da, đau tức hạ sườn phải,...do tổn thương di căn gan; đau ngực, khó thở, suy hô hấp do tổn thương di căn phổi, hạch trung thất; đau bụng vùng thắt lưng, suy thận do tổn thương di căn hạch; đau vùng xương bị di căn, gãy xương; yếu, liệt, hôn mê, tăng áp lực nội sọ (buồn nôn, nôn, đau đầu) do tổn thương di căn não. Toàn thân: da xanh niêm mạc nhợt do thiếu máu, gầy sút cân, suy kiệt.
- Triệu chứng thực thể có thể sờ thấy u qua thành bụng hoặc qua thăm khám trực tràng nếu u ở trực tràng, ống hậu môn. Thăm trực tràng: phát hiện được khối u cách rìa hậu môn dưới 8 cm. Khám toàn thân để phát hiện di căn gan, hạch ngoại vi, dịch cổ trướng, di căn buồng trứng ở phụ nữ, giúp đánh giá mức độ tiến triển bệnh.
+ Xét nghiệm cận lâm sàng
- Nội soi đại trực tràng với ống soi cứng, ống mềm và sinh thiết làm mô bệnh học là tiêu chuẩn vàng để chẩn đoán xác định.
- Siêu âm ổ bụng, chụp X-quang ngực thẳng, chụp cắt lớp vi tính ổ bụng - lồng ngực, cộng hưởng từ sọ não, SPECT, SPECT/CT, PET/CT để đánh giá giai đoạn bệnh (di căn phổi, hạch, gan, não), đánh giá hiệu quả điều trị, tiên lượng, đánh giá tái phát, di căn sau điều trị. Các thăm dò cận lâm sàng khác như: nội soi dạ dày, soi bàng quang khi nghi ngờ u xâm lấn vào các cơ quan này.
- Xét nghiệm công thức máu, đông máu, sinh hóa máu đánh giá tình trạng thiếu máu, chức năng gan – thận. Xét nghiệm chất chỉ điểm khối u trong máu: CEA, CA 19-9 để tiên lượng, theo dõi đáp ứng điều trị, tái phát và di căn. Xét nghiệm đếm tế bào u trong máu (circulating tumor cell - CTCs) giúp tiên lượng bệnh.
- Xét nghiệm tế bào học dịch màng phổi, màng bụng: ly tâm tìm tế bào ung thư hoặc làm xét nghiệm mô học khối tế bào (cell block) để đánh giá di căn.
- Xét nghiệm đột biến gen KRAS, NRAS, BRAF, PTEN, PIK3CA, Heu-2/neu, APC, TP53, giải trình tự nhiều gen. Đánh giá sự bất ổn định vi vệ tinh và thiếu hụt sửa chữa bắt cặp sai dMMR/MSI (deficient mismatch repair/microsatellite instability).
- Chẩn đoán giai đoạn bệnh
Đánh giá giai đoạn theo hệ thống TNM của AJCC ấn bản lần thứ 8 năm 2017.
+ T: U nguyên phát
- Tx: không thể đánh giá khối u nguyên phát
- T0: không có bằng chứng về khối u nguyên phát
- Tis: ung thư biểu mô tại chỗ
- T1: khối u đã xâm lấn lớp dưới niêm mạc
- T2: khối u xâm lấn lớp cơ
- T3: khối u xâm lấn lớp dưới thanh mạc hoặc đến vùng mô quanh trực tràng hoặc
- đại tràng không được phủ phúc mạc
- T4: khối u xâm lấn trực tiếp cơ quan hoặc cấu trúc kế cận và/hoặc xâm lấn vào phúc mạc tạng
T4a: U xâm lấn vào phúc mạc tạng
T4b: U xâm lấn cơ quan kế cận
+ N: Hạch vùng
- Nx: không thể đánh giá được di căn hạch vùng
- N0: không có di căn hạch vùng
- N1: di căn 1-3 hạch vùng
N1a: di căn 1 hạch
N1b: di căn 2-3 hạch
N1c: không có di căn hạch vùng nhưng có nhân di căn ở dưới thanh mạc hoặc mạc treo hoặc vùng trực tràng không được phúc mạc che phủ.
+ N2: di căn 4 hạch vùng trở lên
N2a: di căn 4-6 hạch
N2b: di căn từ 7 hạch trở lên
+ M : Di căn xa
- M0: không có di căn xa
- M1: di căn xa
M1a: di căn xa chỉ ở một vị trí hoặc cơ quan nhưng không di căn phúc mạc
M1b: di căn từ 2 vị trí hoặc cơ quan trở lên nhưng không di căn phúc mạc
M1c: di căn phúc mạc có hoặc không kèm theo di căn vị trí hoặc cơ quan khác
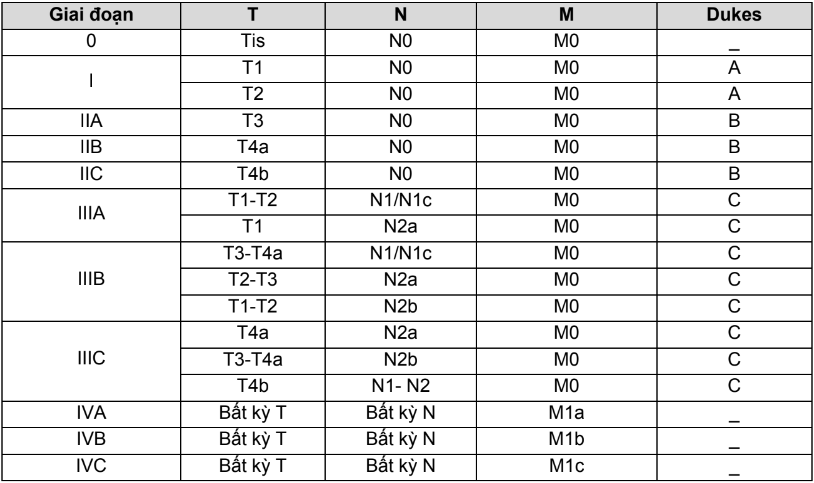
Bảng 4.5. Phân loại giai đoạn theo TNM và Dukes bệnh ung thư đại trực tràng
2.3.3. Điều trị
Tùy thuộc giai đoạn bệnh, vị trí khối u, thể trạng người bệnh mà có thể áp dụng các phương pháp phẫu thuật, hóa trị, xạ trị, điều trị đích, miễn dịch.
- Phẫu thuật là biện pháp cơ bản điều trị ung thư đại trực tràng: phẫu thuật triệt căn, phẫu thuật điều trị triệu chứng (làm hậu môn nhân tạo trên u, điều trị trong trường hợp thủng vỡ u gây viêm phúc mạc).
- Hóa trị được áp dụng: 1) Điều trị bổ trợ sau mổ, nhằm diệt nốt những tế bào ung thư còn sót lại, hạn chế tiến triển, tái phát, di căn; 2) Điều trị trước mổ (hóa trị tiền phẫu) nhằm thu nhỏ kích thước u và tổn thương di căn, tạo điều kiện thuận lợi để phẫu thuật triệt căn; 3) Điều trị ở giai đoạn muộn: thường phối hợp hóa trị với điều trị đích (kháng thể đơn dòng).
- Xạ trị được chỉ định chủ yếu trong ung thư trực tràng thấp, trung bình giai đoạn tiến triển tại chỗ; áp dụng:
- Điều trị bổ trợ sau mổ, nhằm diệt nốt những tế bào ung thư còn sót lại, hạn chế tiến triển, tái phát, di căn;
- Điều trị trước mổ (xạ trị tiền phẫu) hoặc hóa xạ trị trước mổ, nhằm thu nhỏ kích thước u, tạo điều kiện thuận lợi để phẫu thuật triệt căn;
- Điều trị ở giai đoạn muộn: thường phối hợp với hóa trị nhằm điều trị chống chảy máu, chèn ép hoặc xạ trị vào não, xương, gan, phổi...trong trường hợp có di căn các vị trí trên.
- Điều trị đích, miễn dịch: thường áp dụng ở giai đoạn muộn: đã có tổn thương di căn xa; việc lựa chọn phác đồ điều trị cần xem xét đến các xét nghiệm đột biến gen và hóa mô miễn dịch.
- Phác đồ điều trị:
- Giai đoạn I, II: phẫu thuật cắt đoạn đại trực tràng và vét hạch.
- Giai đoạn II nguy cơ cao,
- giai đoạn III: phẫu thuật cắt đoạn đại trực tràng, vét hạch và hóa trị bổ trợ.
- Giai đoạn IV: nếu phẫu thuật được sẽ phẫu thuật cắt đoạn đại trực tràng, kèm theo cắt bỏ tổn thương di căn sau đó hóa trị. Nếu có tiềm năng phẫu thuật: hóa trị bổ trợ 3 chu kỳ trước mổ, sau đó đánh giá lại và xét phẫu thuật và hóa trị tiếp. Nếu có tiềm năng phẫu thuật: hóa trị. Phác đồ hóa trị ở giai đoạn IV thường hóa chất có thể kèm thêm các kháng thể đơn dòng (bevacizumab, cetuximab, panitumumab), nếu sử dụng bevacizumab thì phải dừng thuốc này ít nhất 4 tuần trước phẫu thuật vì bevacizumab làm chậm liền vết thương.
- Các thuốc hay sử dụng: 5 FU, leucovorin, capecitabin, oxaliplatin, irinotecan, tegafur + gimeracil+ oteracil potassium (TS one), tegafur + uracil (Ufur, Mefuform), trifluridin + tipiracil (TAS 102), bevacizumab, cetuximab (dùng khi xét nghiệm đột biến gen KRAS, NRAS, BRAF không đột biến), panitumumab (dùng khi xét nghiệm đột biến gen KRAS, NRAS, BRAF không đột biến), regorafenib, ramucirumab, ziv-aflibercept, vemurafenib (dùng khi có đột biến gen BRAF), dabrafenib (chỉ dùng khi có đột biến gen BRAF), trametinib (dùng khi có đột biến gen BRAF), encorafenib (dùng khi có đột biến gen BRAF), binimetinib (chỉ dùng khi có đột biến gen BRAF), nivolumab (chỉ dùng trong trường hợp dMMR/MSI-high), ipilimumab (dùng trong trường hợp dMMR/MSI- high), pembrolizumab (dùng trong trường hợp dMMR/MSI-high).
- Phác đồ hay sử dụng:
- Điều trị bổ trợ: Phác đồ FOLFOX, XELOX, FUFA, capecitabin.
- Điều trị ở giai đoạn di căn: tân bổ trợ, bổ trợ, triệu chứng: Điều trị bước 1: Phác đồ FOLFOX, XELOX, FOLFIRI ± kháng thể đơn dòng bevacizumab hoặc FOLFOX, XELOX, FOLFIRI ± cetuximab hoặc panitumumab (chỉ trong trường hợp không có đột biến gen KRAS, NRAS, BRAF). Điều trị bước 2: tùy vào điều trị bước 1 là phác đồ có oxaliplatin thì bước 2 là phác đồ có irinotecan và ngược lại, có thể kèm hoặc không kèm kháng thể đơn dòng (bevacizumab, cetuximab, panitumumab). Với người bệnh thể trạng yếu, bác sĩ thường lựa chọn phác đồ đơn chất.
- Một số phác đồ hóa chất:
+ Phác đồ FOLFOX4:
- Oxaliplatin: 85 mg/m2, truyền tĩnh mạch, ngày 1.
- Leucovorin: 200 mg/m2, truyền tĩnh mạch, ngày 1, 2.
- 5 FU: 400 mg/m2, truyền tĩnh mạch, ngày 1, 2.
- 5 FU: 600 mg/m2, truyền tĩnh mạch trong 22 giờ, ngày 1, 2.
- Nhắc lại sau mỗi 2 tuần.
+ Phác đồ FOLFOX6:
- Oxaliplatin: 100 mg/m2, truyền tĩnh mạch, ngày 1.
- Leucovorin: 200 mg/m2, truyền tĩnh mạch, ngày 1, 2.
- 5 FU: 400 mg/m2, tiêm tĩnh mạch, ngày 1, 2.
- 5 FU: 600 mg/m2, truyền tĩnh mạch trong 22 giờ, ngày 1, 2.
- Nhắc lại sau mỗi 2 tuần.
+ Phác đồ mFOLFOX6:
- Oxaliplatin: 85mg/m2, truyền tĩnh mạch, ngày 1.
- Leucovorin: 350mg/m2, truyền tĩnh mạch, ngày 1.
- 5 FU: 400mg/m2, tiêm tĩnh mạch ngày 1, sau đó 5 FU: 2,4g/m2 truyền tĩnh mạch trong 46 giờ liên tục.
- Nhắc lại sau mỗi 2 tuần.
+ Phác đồ FOLFIRI:
- Irinotecan: 180 mg/m2, truyền tĩnh mạch, ngày 1.
- Leucovorin: 200 mg/m2, truyền tĩnh mạch, ngày 1, 2.
- 5 FU: 400 mg/m2, tiêm tĩnh mạch chậm, ngày 1, 2.
- 5 FU: 600mg/m2, truyền tĩnh mạch, ngày 1, 2.
- Nhắc lại sau mỗi 2 tuần.
+ Phác đồ FOLFOXIRI:
- Irinotecan: 165 mg/m2, truyền tĩnh mạch, ngày 1.
- Oxaliplatin: 85 mg/m2, truyền tĩnh mạch, ngày 1.
- Leucovorin 200 mg/m2, truyền tĩnh mạch, ngày 1.
- 5 FU: 3.200 mg/m2, truyền tĩnh mạch trong 48 giờ.
- Lặp lại sau mỗi 02 tuần.
+ Phác đồ XELOX:
- Oxaliplatin: 130 mg/m2, truyền tĩnh mạch, ngày 1
- Capecitabin: 1.000 mg/m2 uống, 2 lần/ngày x 14 ngày.
- Chu kỳ 3 tuần.
+ Phác đồ XELIRI:
- Irinotecan: 240-250 mg/m2, truyền tĩnh mạch trong 90 phút, ngày 1
- Capecitabin: 1.000 mg/m2 uống, 2 lần/ngày x 14 ngày.
- Chu kỳ 3 tuần hoặc
- Irinotecan: 175 mg/m2, truyền tĩnh mạch trong 30 phút, ngày 1
- Capecitabine: 1.000 mg/m2 uống, 2 lần/ngày x 7 ngày.
- Chu kỳ 2 tuần
+ Phác đồ Capecitabin:
- Capecitabin: 1.250 mg/m2 uống, 2 lần/ngày x 14 ngày.
- Hoặc Capecitabin 500 mg, 3 lần/ngày, uống hàng ngày liên tục.
- Hoặc Capecitabin 625 mg, 2 lần/ngày uống hàng ngày liên tục.
- Chu kỳ 3 tuần.
+ Phác đồ TS 1 đơn thuần:
- TS - one 60-80 mg/m2, uống ngày 1-14, chu kỳ 3 tuần (21 ngày).
- hoặc TS - one: 60-80mg/m2, uống ngày 1-28, chu kỳ 6 tuần (42 ngày).
+ Phác đồ UFT:
- UFT (Tegafur + Uracil): 100 mg/m2, uống/ lần x 3 lần/ngày, ngày 1-28
- Folinic acid: 30mg/m2, uống/lần x 3 lần/ngày, ngày 1-28
- Chu kỳ 5 tuần.
hoặc
- UFT (Tegafur + Uracil): 100 -125mg/m2, uống/lần x 3 lần/ngày, ngày 1-14, chu kỳ 21 ngày.
+ Phác đồ Trifluridin/Tipiracil (TAS 102): 35mg/m2, tối đa 80mg/lần, uống 2 lần/ngày, ngày 1-5, 8-12, chu kỳ 28 ngày.
- Một số phác đồ điều trị đích, miễn dịch:
- Bevacizumab: Liều dùng thông thường: 5-15 mg/kg, truyền tĩnh mạch từng đợt, phối hợp với các phác đồ hóa chất 14-21 ngày/lần.
- Cetuximab: Liều dùng: 400 mg/m2 ngày 1 sau đó 250 mg/m2 hàng tuần, truyền tĩnh mạch phối hợp với các phác đồ hóa chất.
- Panitumumab: Liều dùng: 6 mg/kg, truyền tĩnh mạch trong 60-90 phút, mỗi hai tuần hoặc 2,5mg/kg, truyền tĩnh mạch hàng tuần, phối hợp với các phác đồ hóa chất.
- Regorafenib: Liều dùng: Regorafenib 40 mg x 4 viên /ngày, uống một lần/ngày, uống từ ngày 1-21, chu kỳ 28 ngày, có thể điều chỉnh liều tùy thuộc bệnh nhân.
- Ziv-aflibercept: Liều dùng 4 mg/kg truyền tĩnh mạch > 1 giờ mỗi 2 tuần.
- Ramucimumab: Liều dùng 8 mg/kg truyền tĩnh mạch > 1 giờ mỗi 2 tuần.
- Pembrolizumab: 200 mg hoặc 2 mg/kg truyền tĩnh mạch > 30 phút mỗi 3 tuần cho đến khi bệnh tiến triển hoặc độc tính không chấp nhận được hoặc dùng đến 24 tháng ở người bệnh không tiến triển bệnh.
- Nivolumab: 240mg hoặc 3mg/kg truyền tĩnh mạch > 60 phút mỗi 2 tuần cho đến khi bệnh tiến triển hoặc độc tính không chấp nhận được.
2.4. Bệnh ung thư vú
- Ung thư vú là bệnh lý ác tính tại tuyến vú, đây là bệnh ung thư có tỷ lệ mắc cao nhất ở nữ giới Việt Nam và thế giới. Theo Globocan năm 2018, trên thế giới ung thư vú đứng thứ 1 về tỷ lệ mắc ở nữ giới với 2.088.849 trường hợp và số trường hợp tử vong là 626.679 (6,6% các nguyên nhân tử vong do ung thư). Tại Việt Nam, ung thư vú là bệnh phổ biến, với 15.229 trường hợp mỗi năm, chiếm 20,6% trong số các loại bệnh ung thư ở nữ giới.
- Những đối tượng nguy cơ cao mắc bệnh: tiền sử gia đình có mẹ, con gái, chị/em gái bị ung thư vú, có đột biến gen BRCA1 và BRCA2; tuổi cao: phụ nữ ≥ 40 tuổi; phụ nữ có hành kinh sớm (trước 12 tuổi) và mãn kinh muộn (sau 55 tuổi); phụ nữ mang thai muộn (> 30 tuổi), không mang thai, không cho con bú; phụ nữ béo phì, hút thuốc lá; phụ nữ có tiền sử chiếu xạ vào vùng ngực; phụ nữ có tiền sử bị ung thư trước đó: phụ nữ đã bị ung thư một bên vú, ung thư buồng trứng, ung thư nội mạc tử cung, ung thư đại tràng.
- Các phương pháp sàng lọc phát hiện sớm ung thư vú bằng tự khám vú hàng tháng, khám bác sĩ chuyên khoa ung thư định kỳ hằng năm sau tuổi 40 phối hợp với chụp X quang tuyến vú và siêu âm vú 3D để phát hiện sớm bệnh.
2.4.1 Tính chất của bệnh ung thư
Bệnh ung thư vú ở giai đoạn sớm thường phát hiện tình cờ qua thăm khám sức khỏe định kỳ hoặc tự sờ thấy tổn thương nhỏ tại vú, ở giai đoạn này, có thể điều trị khỏi hoàn toàn. Ở giai đoạn tiếp theo, người bệnh thường có biểu hiện tự sờ thấy u vú, hoặc đau tại vú, chảy dịch đầu vú; ở giai đoạn muộn hơn, người bệnh có biểu hiện khối u tại vú to dần và/hoặc kèm theo biểu hiện tại các tổn thương di căn: đau tức hạ sườn phải, vàng da (di căn gan), ho, đau ngực (di căn phổi), đau xương (di căn xương), đau đầu, nôn, yếu liệt (di căn não), gầy sút cân, suy kiệt, loét tại vú.
2.4.2. Chẩn đoán
Dựa vào các triệu chứng lâm sàng và cận lâm sàng
* Triệu chứng lâm sàng
- Triệu chứng cơ năng
- Các triệu chứng thường là người bệnh tự sờ thấy khối u ở vú hoặc tình cờ phát hiện qua các lần khám sức khỏe định kỳ hoặc bệnh đã ở giai đoạn tiến triển.
- Dấu hiệu tại chỗ: đau, chảy dịch hoặc chảy máu tại đầu núm vú, co kéo da vùng vú, giai đoạn muộn khối u có thể xâm lấn gây lở loét, hoại tử ra ngoài da gây chảy dịch, mùi hôi thối, xâm lấn thành ngực gây đau nhiều.
- Hạch ngoại vi: thường là hạch nách hoặc hạch thượng đòn với kích thước khác nhau, chắc, di động hoặc không di động, có thể biểu hiện viêm, hoại tử.
- Toàn thân: gầy sút cân, suy kiệt, da xanh, niêm mạc nhợt do thiếu máu.
- Dấu hiệu di căn xa: tùy thuộc từng vị trí di căn mà có biểu hiện lâm sàng khác nhau. Di căn phổi: đau ngực, khó thở, có thể có suy hô hấp. Di căn phúc mạc: cổ trướng. Di căn xương: đau xương, gãy xương tự nhiên. Vàng da, đau tức hạ sườn phải,...do tổn thương di căn gan. Đau bụng vùng thắt lưng, suy thận do tổn thương di căn hạch trong ổ bụng. Di căn lên não: tùy vị trí di căn có biểu hiện lâm sàng khác nhau, phần lớn biểu hiện hội chứng tăng áp lực nội sọ: đau đầu, buồn nôn và nôn, yếu hoặc liệt nửa người, hội chứng tiểu não, co giật, hôn mê.
- Thực thể
+ Khám vú
- Sờ thấy u vú có ranh giới không rõ, mật độ chắc. U có thể xâm lấn vào thành ngực làm hạn chế di động hoặc xâm nhiễm da tạo hình ảnh "sần da cam" hoặc vỡ loét, đôi khi ung thư vú cũng biểu hiện như một viêm tấy lan tỏa vùng vú (ung thư vú thể viêm).
- Có thể thấy sẹo mổ cũ sưng nề, thâm nhiễm vùng da ngực xung quanh.
+ Khám hạch ngoại vi
- Thường gặp hạch nách, hạch thượng đòn, hạch thường cứng, chắc, di động kém, kích thước to nhỏ khác nhau, có thể có biểu hiện viêm, hoại tử.
+ Khám toàn thân phát hiện các tổn thương di căn xa
- Xét nghiệm cận lâm sàng:
+ Xét nghiệm để chẩn đoán xác định
- Chụp X quang tuyến vú: tổn thương điển hình có dạng hình sao nhiều chân, co kéo tổ chức tuyến vú, có nhiều chấm vi canxi hóa tập hợp thành đám.
- Xét nghiệm tế bào học: thường thấy các tế bào ung thư mất sự kết dính, đa hình thái, tỷ lệ nhân/nguyên sinh chất tăng, nhiều nhân quái nhân chia, bào tương kiềm tính.
- Sinh thiết u bằng kim sinh thiết hoặc sinh thiết hút chân không hoặc sinh thiết mở: cho phép lấy mảnh tổ chức làm xét nghiệm mô bệnh học và các xét nghiệm hóa mô miễn dịch, gen.
+ Các xét nghiệm đánh giá di căn xa
- Siêu âm ổ bụng, chụp cắt lớp vi tính ổ bụng - lồng ngực, cộng hưởng từ sọ não để đánh giá giai đoạn bệnh (di căn hạch, di căn xa).
- Ghi hình với SPECT, SPECT/CT, PET/CT để đánh giá giai đoạn bệnh, hiệu quả điều trị, tiên lượng, đánh giá tái phát, di căn sau điều trị.
+ Xét nghiệm cơ bản đánh giá toàn thân
- Xét nghiệm công thức máu đánh giá tình trạng thiếu máu, nhiễm trùng. Xét nghiệm sinh hoá máu đánh giá chức năng gan, thận.
- Xét nghiệm chất chỉ điểm khối u trong máu: CEA, CA 15-3.
- Xét nghiệm đếm tế bào u trong máu (circulating tumor cell - CTCs) giúp tiên lượng bệnh.
+ Mô bệnh học và hóa mô miễn dịch
- Đánh giá tình trạng thụ thể nội tiết: ER, PR, Her-2/neu, P53, Ki-67.
+ Xét nghiệm gen: BRCA1, BRCA2, giải trình tự nhiều gen
* Chẩn đoán giai đoạn bệnh
Đánh giá giai đoạn theo hệ thống TNM của AJCC năm 2017.
- T: khối u
+ Tx: không đánh giá được u nguyên phát.
+ T0: không có dấu hiệu u nguyên phát.
+ Tis: ung thư biểu mô nội ống tại chỗ (DCIS), bệnh Paget của núm vú.
+ T1: đường kính lớn nhất của u ≤ 2 cm.
- T1mi: đường kính lớn nhất của khối u ≤ 1mm.
- T1a: 1mm < đường kính lớn nhất của khối u ≤ 5mm.
- T1b: 5mm < đường kính lớn nhất của khối u ≤ 10mm.
- T1c: 10mm < đường kính lớn nhất của khối u ≤ 20mm.
+ T2: 2cm < đường kính u ≤ 5 cm.
+ T3: đường kính u > 5 cm.
+ T4: u với mọi kích thước nhưng xâm lấn trực tiếp tới thành ngực hoặc da (thành ngực bao gồm xương sườn, cơ gian sườn, cơ răng trước, không tính cơ ngực lớn).
- T4a: u xâm lấn tới thành ngực.
- T4b: phù da cam, loét da vú, hoặc có nhiều u nhỏ vệ tinh ở vú cùng bên.
- T4c: bao gồm cả T4a và Tab.
- T4d: ung thư vú dạng viêm.
- N: Hạch vùng
+ Nx: hạch vùng không xác định được.
+ N0: không có di căn tới hạch vùng được xác định hoặc chỉ xác định được lượng rất ít (lượng có tế bào ác tính rất nhỏ ≤ 0,2mm).
+ N1: vi di căn vào hạch (< 2mm) hoặc di căn 1-3 hạch nách và/hoặc lâm sàng chưa có di căn hạch vú trong kèm theo có di căn hạch cửa.
- pN1mi: vi di căn (khoảng 200 tế bào, 0,2mm < vi di căn < 2mm).
- pN1a: di căn 1-3 hạch nách, có ít nhất 1 hạch > 2mm.
- pN1b: di căn gác là hạch vú trong cùng bên.
- pN1c: gồm cả pN1a và pN1b.
+ N2: di căn 4-9 hạch nách cùng bên hoặc di căn hạch vú trong cùng bên trên chẩn đoán hình ảnh mà không có di căn hạch nách.
- pN2a: di căn 4-9 hạch nách (có ít nhất 1 hạch ≥ 2mm).
- pN2b: trên lâm sàng phát hiện di căn hạch vú trong mà có hoặc không khẳng định bằng mô bệnh học; kèm theo không di căn hạch nách được khẳng định bằng mô bệnh học.
+ N3: di căn ≥ 10 hạch nách hoặc hạch nách nhóm III (hạch hạ đòn), hoặc di căn hạch vú trong cùng bên kèm theo có di căn ≥ 1 hạch nách nhóm I, II trên chẩn đoán hình ảnh hoặc di căn > 3 hạch nách và di căn hạch cửa nhưng không di căn hạch vú trong cùng bên hoặc di căn hạch thượng đòn cùng bên.
- pN3a: di căn ≥ 10 hạch nách (ít nhất 1 hạch > 2mm) hoặc di căn hạch hạ đòn (hạch nách nhóm III).
- pN3b: pN1a hoặc pN2a với cN2b (hạch vú trong dương tính trên chẩn đoán hình ảnh) hoặc pN2a với pN1b.
- pN3c: di căn hạch thượng đòn cùng bên.
- M: Di căn xa
+ Mx: không xác định được di căn xa ở thời điểm chẩn đoán.
+ M0: không có di căn xa.
- cM1: di căn xa được phát hiện bằng lâm sàng hoặc chẩn đoán hình ảnh.
- pM1: di căn xa được khẳng định bằng mô bệnh học hoặc di căn vào hạch không thuộc nhóm hạch vùng có kích thước > 0,2mm.
Bảng 4.6. Chẩn đoán giai đoạn theo TNM bệnh ung thư vú
2.4.3. Điều trị
- Điều trị ung thư vú là sự phối hợp của nhiều phương pháp điều trị ung thư (điều trị đa mô thức) bao gồm: phẫu thuật, xạ trị, hoá trị, nội tiết, đích, miễn dịch. Ở giai đoạn sớm, phẫu thuật đóng vai trò chủ đạo, tùy thuộc vị trí, kích thước khối u vú, tuổi... có thể phẫu thuật lấy rộng u, vét hạch nách (phẫu thuật bảo tồn) hoặc phẫu thuật cắt toàn bộ tuyến vú kèm theo vét hạch nách (phẫu thuật Patey). Phẫu thuật tạo hình cũng được áp dụng để tạo sự tự tin cho người bệnh, nhất là các phụ nữ trẻ. Ở giai đoạn tiếp theo, cần có sự phối hợp phẫu thuật, hóa trị và/hoặc xạ trị, nội tiết (tùy giai đoạn bệnh, loại mô bệnh học, tuổi, thụ thể nội tiết...) Ở giai đoạn muộn: điều trị toàn thân (hóa trị, nội tiết, đích, miễn dịch) giữ vai trò chủ đạo, trong đó hóa trị là biện pháp cơ bản nhất để điều trị ở giai đoạn này, ngoài hóa trị chuẩn thì việc sử dụng hóa trị metronomic (sử dụng thuốc liều thấp thường xuyên trong thời gian dài mà không ngắt quãng) mang lại lợi ích rất tốt cho bệnh nhân không phù hợp với hóa trị chuẩn. Nội tiết và điều trị đích, miễn dịch được áp dụng tùy thuộc vào các kết quả xét nghiệm thụ thể nội tiết ER, PR, Heu2/neu... Xạ trị được áp dụng điều trị phối hợp khi đã có tổn thương di căn (hạch, di căn xa: xương, não...); xạ trị cũng có thể được áp dụng trong mổ hoặc sau mổ đối với trường hợp phẫu thuật bảo tồn. Xạ trị triệu chứng nhằm giảm đau, giảm chảy máu với khối u xâm lấn thành ngực, khối u gây chảy máu, hoại tử.
- Các thuốc hay sử dụng điều trị bệnh ung thư vú: doxorubicin, epirubicin, cyclophosphamid, 5FU, capecitabin, vinorelbin, gemcitabin, paclitaxel, docetaxel, methotrexat, vinblastin, adriamycin, mitomycin C, carboplatin, trastuzumab (chỉ định khi Heu2/neu dương tính), pertuzumab (chỉ định khi Heu2/neu dương tính), ado-trastuzumab emtansine (T-DM1), liposomal doxorubicin, eribulin, albumin-bound paclitaxel, cisplatin, lapatinib, olaparid, atezolizumab, bevacizumab.
- Điều trị nội tiết: phụ nữ trẻ chưa mãn kinh: tamoxifen; đã mãn kinh: anastrozol, letrozol, exemestane, fulvestran.
- Thuốc ức chế mTor: everolimus, sirolimus, tesmirolimus.
- Thuốc ức chế PI3K: taselisib, alpelisib, buparlisib.
- Thuốc ức chế đặc hiệu PARP: olaparib, rucaparib, talazoparib, veliparib: người bệnh có BRCA dương tính.
- Một số phác đồ hóa chất
+ Phác đồ AC
- Doxorubicin 60 mg/m2 , truyền tĩnh mạch ngày 1.
- Cyclophosphamid 60 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 21 ngày.
+ Phác đồ CAF
- Cyclophosphamid 500 mg/m2, truyền tĩnh mạch ngày 1.
- Doxorubicin 50 mg/m2, truyền tĩnh mạch ngày 1.
- 5-Fluorobicin 500 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 21 ngày
+ Phác đồ CMF
- Cyclophosphamid 10 mg/m2, uống, ngày 1-14.
- Methotrexat 40 mg/m2, truyền tĩnh mạch ngày 1-8.
- 5-Fluorouracil 600 mg/m2, truyền tĩnh mạch ngày 1, 8.
Hoặc
- Cyclophosphamid 100 mg/m2, truyền tĩnh mạch ngày 1-14.
- Methotrexat 30 mg/m2, truyền tĩnh mạch ngày 1, 8.
- 5-Fluorouracil 400 mg/m2, truyền tĩnh mạch ngày 1, 8.
- Chu kỳ 28 ngày, điều trị 6 đợt.
+ Phác đồ TA:
- Doxorubicin 50 mg/m2, truyền tĩnh mạch ngày 1.
- Docetaxel 75 mg/m2, truyền tĩnh mạch ngày 1.
+ Phác đồ TAC:
- Doxorubicin 50 mg/m2, truyền tĩnh mạch ngày 1.
- Sau đó, docetaxel 75 mg/m2, truyền tĩnh mạch ngày 1.
- Cyclophosphamid 500 mg/m2, truyền tĩnh mạch ngày 1.
+ Phác đồ VC:
- Vinorebin 30 mg/m2, truyền tĩnh mạch ngày 1, 8.
- Cisplatin 75 mg/m2, truyền tĩnh mạch ngày 1.
- Nhắc lại mỗi đợt sau 21 ngày.
+ Phác đồ AC liều dày sau đó dùng paclitaxel.
- Doxorubicin 60 mg/m2, truyền tĩnh mạch ngày 1.
- Cyclophosphamid 600 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 14 ngày x 4 chu kỳ. Sau đó:
- Paclitaxel 175 mg/m2, truyền tĩnh mạch trong 3 giờ, ngày 1.
- Chu kỳ 14 ngày x 4 chu kỳ.
Hoặc sau đó:
- Paclitaxel 80 mg/m2, truyền tĩnh mạch trong 1 giờ, hàng tuần đến 12 tuần.
+ Phác đồ TC
- Doxetaxel 75 mg/m2, truyền tĩnh mạch ngày 1.
- Cyclophosphamid 600 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 21 ngày x 4 chu kỳ.
+ Phác đồ TAC
- Docetaxel 75 mg/m2, truyền tĩnh mạch ngày 1.
- Doxorubicin 50 mg/m2, truyền tĩnh mạch ngày 1.
- Cyclophosphamide 500 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 21 ngày x 6 chu kỳ.
+ Phác đồ AC, sau đó docetaxel
- Doxorubicin 60 mg/m2, truyền tĩnh mạch ngày 1.
- Cyclophosphamide 600 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 21 ngày x 4 chu kỳ.
- Sau đó: Docetaxel 100 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 21 ngày x 4 chu kỳ
+ Phác đồ EC
- Epirubicin 100 mg/m2, truyền tĩnh mạch ngày 1.
- Cyclophosphamid 830 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 21 ngày x 8 chu kỳ.
- Hoặc Epirubicin 100 mg/m2, truyền tĩnh mạch ngày 1.
- Cyclophosphamid 600 mg/m2truyền tĩnh mạch ngày 1.
- Chu kỳ 21 ngày
+ Phác đồ Vinorelbin
- Vinorelbin: 25 mg/m2, truyền tĩnh mạch ngày 1 mỗi tuần hoặc 30-35 mg/m2,truyền tĩnh mạch ngày 1, 8 chu kỳ 21 ngày.
- Hoặc Vinorelbin: 60-80 mg/m2, uống ngày 1, 8, 15 chu kỳ 28 ngày.
- Hoặc Vinorelbin: 60-80 mg/m2, uống hàng tuần.
- Hoặc Vinorelbin: 30-50 mg/lần, uống 3 lần/tuần.
+ Phác đồ capecitabin
- Capecitabin 1.000-1.250 mg/m2/lần, uống 2 lần mỗi ngày, ngày 1-14.
- Một số phác đồ điều trị đích, miễn dịch:
+ Trastuzumab
- Dùng kết hợp với hóa trị: trastuzumab 4 mg/kg truyền tĩnh mạch lần đầu, sau đó trastuzumab 2 mg/kg truyền tĩnh mạch hàng tuần.
- Hoặc trastuzumab 8 mg/kg truyền tĩnh mạch lần đầu, sau đó, trastuzumab 6mg/kg truyền tĩnh mạch mỗi 21 ngày.
+ Pertuzumab
- Dùng kết hợp với hóa trị và trastuzumab.
- Pertuzumab 840 mg/kg, truyền tĩnh mạch ngày 1 trong 60 phút, sau đó, 420mg/kg, truyền tĩnh mạch trong 30-60 phút, chu kỳ mỗi 21 ngày.
+ Ado-trastuzumab emtansine (T-DM1) 3,6 mg/kg truyền tĩnh mạch ngày 1 chu kỳ mỗi 21 ngày.
+ Atezolizumab
- Atezolizumab 1.200 mg, truyền tĩnh mạch mỗi 3 tuần, dùng đơn chất hoặc phối hợp với hóa chất.
+ Lapatinib
- Lapatinib 1.250 mg uống hàng ngày, đơn chất hoặc phối hợp với capecitabin hoặc kháng thể đơn dòng.
2.5. Bệnh ung thư dạ dày
- Ung thư dạ dày là bệnh lý ác tính tại dạ dày, là một trong các loại ung thư phổ biến trong các ung thư đường tiêu hóa.
- Theo Globocan năm 2018, thế giới hàng năm có 1.033.701 trường hợp ung thư dạ dày mới mắc và 782.685 trường hợp tử vong (chiếm 8,2% nguyên nhân tử vong do ung thư). Tại Việt Nam, bệnh thường gặp ở cả hai giới, đứng hàng thứ 3 sau ung thư gan, phổi ở nam và đứng hàng thứ 4 sau ung thư vú, đại trực tràng, phổi ở nữ về tỷ lệ mắc; hàng năm có 17.527 trường hợp mới mắc.
- Những đối tượng nguy cơ cao mắc bệnh: Những người có tiền sử phẫu thuật cắt dạ dày do loét có nguy cơ mắc bệnh cao gấp 2 - 4 lần người bình thường. Người có các tổn thương như viêm teo dạ dày, vô toan, thiếu máu ác tính, dị sản ruột, u tuyến dạ dày cũng được xem là có nguy cơ mắc bệnh cao hơn.
2.5.1. Tính chất của bệnh ung thư
Bệnh ung thư dạ dày ở giai đoạn sớm thường phát hiện tình cờ qua nội soi dạ dày qua thăm khám sức khỏe định kỳ, ở giai đoạn này, có thể chỉ cần cắt hớt tổn thương qua nội soi và theo dõi định kỳ. Ở giai đoạn tiếp theo, người bệnh thường có biểu hiện đau bụng, ợ hơi, ợ chua, đau tức vùng thượng vị; giai đoạn muộn hơn người bệnh có biểu hiện tự sờ thấy khối ở bụng, đau bụng kèm theo biểu hiện tại các tổn thương di căn: sờ thấy hạch thượng đòn, đau tức hạ sườn phải, vàng da (di căn gan), ho, đau ngực (di căn phổi), đau xương (di căn xương), đau đầu, nôn, yếu liệt (di căn não), gầy sút cân, suy kiệt, tắc ruột (đau bụng từng cơn, bí đại tiện, nôn), thủng vỡ u dạ dày (đau bụng dữ dội, bụng cứng,...).
2.5.2. Chẩn đoán:
Dựa vào các triệu chứng lâm sàng và cận lâm sàng.
* Triệu chứng lâm sàng
- Giai đoạn sớm: Triệu chứng nghèo nàn. Biểu hiện: đau tức vùng thượng vị, cảm giác đầy bụng, chậm tiêu, ợ hơi, chán ăn hoặc không có triệu chứng gì.
- Giai đoạn tiến triển: đau bụng là dấu hiệu thường gặp nhất, đau không có chu kỳ, không liên quan đến bữa ăn. Buồn nôn, nôn nếu khối u ở môn vị và tâm vị. Khó nuốt nếu khối u ở tâm vị. Suy nhược toàn thân, gầy sút nhanh. Hội chứng thiếu máu: da xanh, niêm mạc nhợt. Hội chứng xuất huyết: nôn ra máu, đi ngoài phân đen. Khám có thể sờ thấy khối u hoặc đám cứng ở trên rốn. Phát hiện các dấu hiệu di căn: cổ trướng, gan to, di căn hạch thượng đòn.
* Xét nghiệm cận lâm sàng
- Nội soi thực quản- dạ dày ống mềm: Qua nội soi có thể quan sát trực tiếp tổn thương, xác định vị trí, hình dạng, kích thước tổn thương. Đồng thời, tiến hành sinh thiết tổn thương để chẩn đoán mô bệnh học.
- Siêu âm, chụp cắt lớp vi tính ổ bụng-lồng ngực, cộng hưởng từ sọ não, xạ hình xương, PET/CT: đánh giá tổn thương di căn hạch, gan, buồng trứng, phổi, não,...
- Xét nghiệm máu: Công thức máu, đông máu, sinh hóa máu: đánh giá bilan, tình trạng thiếu máu,...
- Xét nghiệm chất chỉ điểm khối u trong máu: CEA, CA72-4, CA 19-9,... có giá trị theo dõi, đánh giá kết quả điều trị.
- Mô bệnh học và hóa mô miễn dịch
- Giúp đánh giá thể mô bệnh học, mức độ biệt hóa, nhuộm hóa mô miễn dịch để đánh giá thụ thể Heu-2/neu, PD-L1...
- Xét nghiệm sinh học phân tử: Xét nghiệm đột biến gen, giải trình tự nhiều gen.
* Chẩn đoán giai đoạn
Đánh giá giai đoạn theo hệ thống TNM của Hiệp hội Ung thư Hoa Kỳ (American Joint Committee on Cancer-AJCC) năm 2017.
- T: U nguyên phát
+ Tis: ung thư biểu mô tại chỗ.
+ T1: u xâm lấn đến lớp niêm mạc, dưới niêm mạc.
- T1a: u xâm lấn lớp niêm mạc.
- T1b: u xâm lấn lớp dưới niêm mạc.
+ T2: u xâm lấn đến lớp cơ.
+ T3: u xâm lấn lớp dưới thanh mạc.
+ T4: u xâm lấn thanh mạc hoặc các cấu trúc lân cận.
- T4a: u xâm lấn lớp thanh mạc.
- T4b: u xâm lấn các cấu trúc lân cận.
- N: Hạch vùng
+ N0: không có hạch.
+ N1: di căn 1-2 hạch.
+ N2: di căn 3-6 hạch.
+ N3: di căn trên 6 hạch vùng.
- N3a: di căn 7-15 hạch.
- N3b: di căn từ 16 hạch trở lên.
- M: Di căn xa
+ M0: chưa di căn xa.
+ M1: di căn xa.
Bảng 4.7. Xếp loại giai đoạn theo TNM lâm sàng (cTNM) bệnh ung thư dạ dày
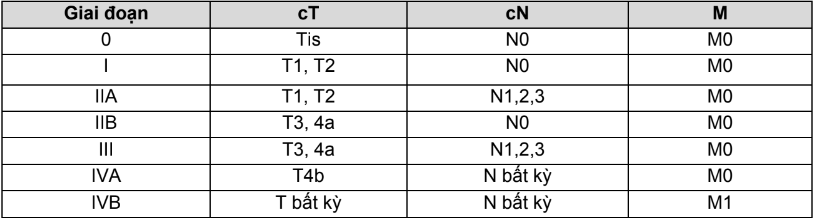
Bảng 4.8. Xếp loại giai đoạn bệnh sau mổ theo TNM (pTNM) bệnh ung thư dạ dày
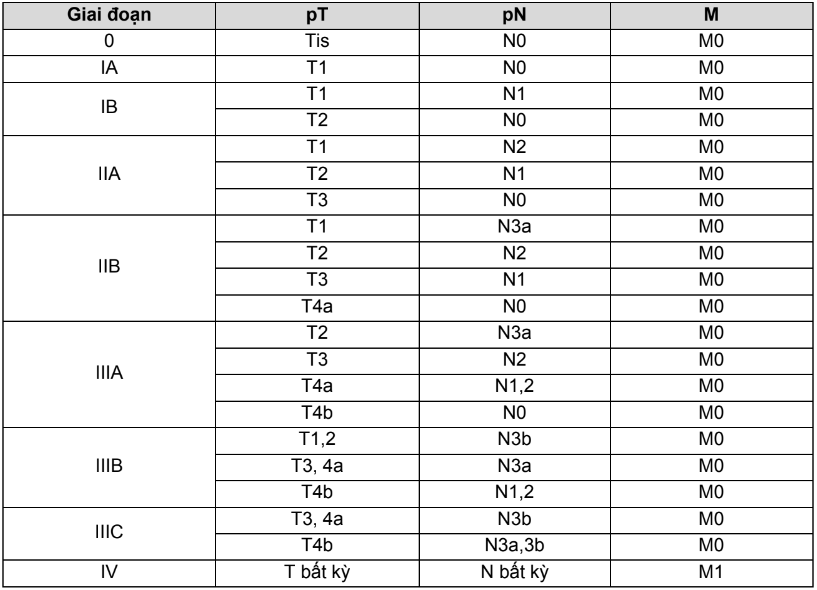
2.5.3. Điều trị
- Tùy thuộc giai đoạn bệnh, vị trí khối u, thể trạng người bệnh mà có thể áp dụng các phương pháp phẫu thuật, hóa trị, xạ trị, điều trị đích, miễn dịch.
- Phẫu thuật là biện pháp cơ bản điều trị ung thư dạ dày: phẫu thuật triệt căn: cắt đoạn dạ dày và nạo vét hạch, phẫu thuật điều trị triệu chứng (nối vị tràng, mở thông hỗng tràng điều trị trong trường hợp thủng vỡ u gây viêm phúc mạc,...).
- Xạ trị được chỉ định trong ưng thư dạ dày giai đoạn muộn hoặc di căn hạch, tuy nhiên ít được áp dụng.
- Hóa trị được áp dụng:
- Điều trị trước mổ (hóa trị tiền phẫu) nhằm thu nhỏ kích thước u và tổn thương di căn, tạo điều kiện thuận lợi để phẫu thuật triệt căn;
- Điều trị bổ trợ sau mổ, nhằm diệt nốt những tế bào ung thư còn sót lại, hạn chế tiến triển, tái phát, di căn;
- Điều trị ở giai đoạn muộn: hóa trị giữ vai trò chủ đạo, có thể phối hợp với điều trị đích (kháng thể đơn dòng). Các thuốc hay sử dụng trong điều trị bệnh ung thư dạ dày bao gồm: cisplatin, carboplatin, oxaliplatin; leucovorin, etoposid, 5FU, doxorubicin, farmorubicin, paclitaxel, docetaxel, irinotecan, capecitabin, tegafur + gimeracil + oteracil potassium (TS one), tegafur + uracil (Ufur, Mefuform), trifluridin + tipiracil,...
- Điều trị đích, miễn dịch: thường áp dụng ở giai đoạn muộn: đã có tổn thương di căn xa; việc lựa chọn phác đồ điều trị cần xem xét đến các xét nghiệm hóa mô miễn dịch và đột biến gen. Các thuốc hay sử dụng: trastuzumab, ramucirumab, pembrolizumab.
- Một số phác đồ hóa chất:
+ Phác đồ FLOT:
- Oxaliplatin 85 mg/m2, truyền tĩnh mạch ngày 1.
- Leucovorin 200 mg/m2, truyền tĩnh mạch ngày 1.
- 5FU 2.600 mg/m2, truyền tĩnh mạch liên tục 24 giờ ngày 1.
- Docetaxel 50 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 14 ngày.
+ Phác đồ EOX:
- Epirubicin 50 mg/m2, truyền tĩnh mạch ngày 1.
- Oxaliplatin 135 mg/m2, truyền tĩnh mạch ngày 1 trong 2 giờ.
- Capecitabin 625 mg/m2/ngày, uống 2 lần/ngày, ngày 1-21.
- Chu kỳ 21 ngày.
+ Phác đồ PC:
- Paclitaxel 50 mg/m2, truyền tĩnh mạch ngày 1.
- Carboplatin AUC 2, truyền tĩnh mạch ngày 1.
- Hàng tuần x 5 tuần.
+ Phác đồ XELOX:
- Capecitabin 1.000 mg/m2, uống 2 lần/ngày, ngày 1-14.
- Oxaliplatin 130 mg/m2, truyền tĩnh mạch ngày 1.
- Chu kỳ 21 ngày.
+ Phác đồ DCF:
- Docetaxel 40 mg/m2, truyền tĩnh mạch ngày 1.
- Leucovorin 400 mg/m2, truyền tĩnh mạch ngày 1.
- 5 FU 400 mg/m2, truyền tĩnh mạch ngày 1.
- 5 FU 1.000 mg/m2, truyền tĩnh mạch 24 giờ ngày 1.
- Cisplatin 40 mg/m2, truyền tĩnh mạch ngày 3.
- Chu kỳ 14 ngày.
+ Phác đồ docetaxel
- Docetaxel 75-100 mg/m2, truyền tĩnh mạch ngày 1.
+ Phác đồ paclitaxel
- Paclitaxel 135-250 mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 21 ngày.
Hoặc:
- Paclitaxel 80 mg/m2, truyền tĩnh mạch hàng tuần. Chu kỳ 28 ngày.
+ Phác đồ irinotecan
- Irinotecan 250-350 mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 21 ngày.
Hoặc:
- Irinotecan 150-80 mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 14 ngày.
Hoặc:
- Irinotecan 125 mg/m2, truyền tĩnh mạch ngày 1, 8. Chu kỳ 21 ngày.
+ Phác đồ IC:
- Irinotecan 65 mg/m2, truyền tĩnh mạch ngày 1, 8.
- Cisplatin 25-30 mg/m2, truyền tĩnh mạch ngày 1, 8. Chu kỳ 21 ngày.
Hoặc:
- Irinotecan 65 mg/m2, truyền tĩnh mạch ngày 1, 8.
- Cisplatin 25-50 mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 21 ngày.
+ Phác đồ docetaxel + irinotecan
- Docetaxel 35 mg/m2, truyền tĩnh mạch ngày 1, 8.
- Irinotecan 50 mg/m2, truyền tĩnh mạch ngày 1, 8. Chu kỳ 21 ngày.
+ Phác đồ irinotecan + capecitabin
- Irinotecan 250 mg/m2, truyền tĩnh mạch ngày 1.
- Capecitabin 1.000 mg/m2, uống 2 lần/ngày, ngày 1-14. Chu kỳ 21 ngày.
+ Phác đồ TS-one + cisplatin
- TS-one 80 mg/m2, uống ngày 1-21.
- Cisplatin 60 mg/m2, tĩnh mạch ngày 8. Chu kỳ 5 tuần.
Hoặc:
- TS-one 80 mg/m2, uống ngày 1-14.
- Cisplatin 60 mg/m2, tĩnh mạch ngày 1. Chu kỳ 3 tuần.
Hoặc:
- TS-one 80 mg/m2, uống ngày 1-14.
- Oxaliplatin 100 mg/m2, tĩnh mạch ngày 1. Chu kỳ 3 tuần.
+ Phác đồ TS one đơn chất
- TS-one 80 mg/m2, uống ngày 1-28. Chu kỳ 6 tuần.
Hoặc:
- TS-one 80 mg/m2, uống ngày 1-14. Chu kỳ 3 tuần.
+ Phác đồ capecitabin đơn chất
- Capecitabine 1.000-1.250mg/m2, uống 2 lần/ngày, ngày 1-14. Chu kỳ 3 tuần.
- Hoặc capecitabin 500mg, 3 lần/ngày, uống liên tục hàng ngày
- Hoặc Capecitabin 625 mg, 2 lần/ngày uống liên tục hàng ngày
+ Phác đồ tegafur
- Tegafur 360 mg/m2 (Ufur, Mefuform), uống ngày 1-14. Chu kỳ 3 tuần.
- Một số phác đồ điều trị đích, miễn dịch:
+ Trastuzumab:
- Trastuzumab 8 mg/kg, truyền tĩnh mạch lần đầu sau đó 6mg/kg mỗi 21 ngày phối hợp với hóa trị ở người bệnh có Heu-2/neu dương tính.
- Hoặc trastuzumab 4 mg/kg truyền tĩnh mạch tuần 1 sau đó trastuzumab 2mg/kg hàng tuần phối hợp với hóa trị ở người bệnh có Heu-2/neu dương tính.
+ Ramucirumab:
- Ramucirumab 8 mg/kg, tĩnh mạch ngày 1. Chu kỳ 14 ngày.
Hoặc:
- Ramucirumab 8 mg/kg, tĩnh mạch ngày 1, 15. Chu kỳ 28 ngày.
+ Pembrolizumab:
- Pembrolizumab 200 mg, truyền tĩnh mạch ngày 1. Chu kỳ 21 ngày.
Hướng dẫn thực hành dược lâm sàng cho dược sĩ trong một số bệnh không lây nhiễm - Bộ y tế 2019
Hướng dẫn chẩn đoán và điều trị một số bệnh về thận, tiết niệu - Bộ y tế 2015
Ban hành kèm theo Quyết định số 3108/QĐ-BYT ngày 28/7/2015 của Bộ trưởng Bộ Y tế
Có nhiều loại thảo dược tốt cho nam giới giúp cải thiện vấn đề cương dương .

Rối loạn cương dương là vấn đề xảy ra phổ biến ở những nam giới lớn tuổi nhưng hiện nay, số người trẻ tuổi gặp phải vấn đề này đang ngày một tăng

Rối loạn cương dương là một trong những vấn đề về chức năng tình dục phổ biến nhất ở nam giới. Trong nhiều trường hợp thì rối loạn cương dương chỉ là vấn đề tạm thời.

Bệnh vẩy nến hiện chưa có cách chữa trị khỏi nên mục đích của việc điều trị là làm giảm các triệu chứng và tần suất bùng phát bệnh. Có nhiều cách để kiểm soát tình trạng bệnh.

Duy trì lượng đường trong máu ổn định là điều rất quan trọng để kiểm soát bệnh tiểu đường. Bên cạnh các phương pháp điều trị truyền thống như tiêm insulin hay dùng thuốc đường uống, người mắc bệnh tiểu đường còn có thể lựa chọn các phương pháp điều trị bổ sung và thay thế. Các phương pháp điều trị này giúp cải thiện sức khỏe thể chất và tinh thần cho người bệnh.
- 1 trả lời
- 1812 lượt xem
- Thưa bác sĩ, tôi bị bệnh da liễu mạn tính. Tôi có cần điều trị đặc biệt gì trước khi mang thai không ạ? Cảm ơn bác sĩ!
- 1 trả lời
- 1583 lượt xem
- Thưa bác sĩ, tôi bị bệnh tuyến giáp. Tôi có cần biết điều gì trước khi có thai không ạ? Cảm ơn bác sĩ!
- 1 trả lời
- 2219 lượt xem
Em bị nhiễm nấm Candida ở lưỡi nên thường hay phải sử dụng bột rơ lưỡi có chứa Nystatin. Nhưng trong thời gian em đang mang thai, liệu điều đó có làm ảnh hưởng tới sự phát triển của thai nhi không?
- 0 trả lời
- 674 lượt xem
Bé nhà em đang được 3 tháng tuổi. Hai hôm nay bé nhà em hay hắt xì rồi ho có đờm nữa. Có phương pháp tự nhiên nào để chữa ho cho bé không ạ? Vì em không muốn bé dùng thuốc tây ạ.
- 1 trả lời
- 778 lượt xem
Lần mang thai trước, em đã buộc phải bỏ thai (7 tháng) bằng phương pháp sinh non vì thai mắc phải hội chứng patau khá nặng. Bác sĩ có khuyên 2 tháng sau, hai vợ chồng nên đến Bv khám lại để tầm soát cho lần mang thai sau. Nhưng từ đó đến nay (khoảng 5 tháng), em chưa sắp xếp để vào khám lại được thì giờ em phát hiện ra mình đã có thai được khoảng 2 tuần. Em đang rất lo lắng, không biết nên thế nào - Mong được bác sĩ tư vấn dùm?