Xét nghiệm xác định đột biến thalassemia - Bộ y tế 2017
I. NGUYÊN LÝ
Xét nghiệm xác định đột biến thalassemia sử d ng bộ sinh phẩm α-globin và β- globin stripassay được phát triển d a trên nguyên lý của k thu t lai DN ngược. K thu t sử d ng thanh teststrip có đính nhiều đầu d để phát hiện đột biến và xác định tính đ ng hợp/ dị hợp tử của đột biến. Bộ x t nghiệm α-globin strip ssay cho ph p sàng lọc 21 đột biến α-thalassemia và bộ x t nghiệm β-globin strip ssay cho ph p sàng lọc 22 đột biến β-thalasemia phổ biến trong khu v c Đông Nam Á.
II. CHỈ ĐỊNH
Chỉ định cho người bệnh thalassemia và các trường hợp nghi ngờ mang đột biến gen globin liên quan đến bệnh lý huyết sắc tố.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN B
1. Người thực hiện
- Nhân viên xét nghiệm sinh học phân tử đã được đào tạo.
2. Phương tiện - Hóa chất
2.1. Phương tiện
- Buồng vô trùng (Biology cabinet);
- Máy ly t m tốc độ cao (tốc độ tối đa 14.000 v ng/phút);
- Máy vortex;
- Các loại pipet 10 μl, 20 μl, 100 μl, 200 μl, 1000 μl;
- Đầu côn có màng lọc;
- Ống eppendorf 1,5 ml vô trùng, không có enzym nuclease;
- Óng PCR 0,2 ml vô trùng, không có enzym nuclease;
- Tủ lạnh 4-8oC, tủ -20oC;
- Găng tay.
2.2 Hóa chất
- Sử d ng sinh phẩm tách DN thương mại. Nếu tách thủ công th sử d ng các sinh phẩm cần thiết để tách chiết DN như dung dịch ly giải màng tế bào, dung dịch biến tính protein, các dung dịch rửa, c n tuyệt đối.
- Bộ sinh phẩm α-Globin Stripassay và β-Globin Stripassay.
3. Bệnh phẩm
2 ml máu toàn phần đ ng trong ống chống đông EDT .
4. Phiếu xét nghiệm
Có đầy đủ các thông tin cần thiết về người bệnh như: tên, tuổi, nơi ở, chẩn đoán ban đầu, yêu cầu x t nghiệm.
V. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- 2 ml máu ngoại vi chống đông bằng EDT , bảo quản mẫu trong -200C nếu chưa th c hiện x t nghiệm.
2. Tiến hành kỹ thuật
* Bước 1 Tách chiết ADN
Phương pháp tách chiết DN cơ bản bao g m các giai đoạn chính sau:
- Phá màng tế bào và màng nhân:
- Tế bào được ủ trong một dung dịch g m chất tẩy mạnh (như SDS, sarcosyl), chất g y biến tính protein (guanidinium thyocianat) và chất khử (2-mercaptoethanol). Mục đích của bước này là để phá màng tế bào và màng nh n đ ng thời để ức chế hoạt động của các enzym RNase nội bào, biến tính protein để giải phóng các ph n tử DN ở trạng thái t do.
- Loại bỏ các protein:
- Sử dụng dung dịch phenol: chloroform để biến tính protein, làm cho protein tạo thành một lớp tủa r rệt sau khi ly t m, dễ dàng loại b kh i hỗn dịch.
- Tủa ADN:
- Sử dụng isopropanol hoặc ethanol với muối để tủa DN trong điều kiện nhiệt độ âm sâu rồi thu nhận ADN bằng ly tâm. DN được tái h a tan trong nước tinh sạch đã khử enzym (free-nuclease).
* Bước 2. Thực hiện phản ứng PCR
- Giữ tất cả hóa chất và DN khuôn trong khay giữ lạnh. Tiến hành tất cả các bước ở trên khay trữ lạnh (0-4oC) cho đến khi bắt đầu chạy máy.
- Chuẩn bị dịch hỗn hợp g m Taq DN Polymerase và Taq Dilution Buffer.
- Chuẩn bị thành phần cho phản ứng PCR theo bảng sau:
| β-globin stripassay (1 pứ/mẫu) | α-globin stripassay (3 pứ/mẫu) |
|
15 μl mplification Mix 5 μl Taq DN Polymerase (0,2 U/μl) 5 μl DN khuôn |
A1: 15 μl mplification Mix 1 5 μl Taq DN Polymerase (0,33 U/μl) 5 μl DN khuôn A2: 15 μl mplification Mix 2 5 μl Taq DN Polymerase (0,33 U/μl) 5 μl DN khuôn B: 15 μl mplification Mix B 5 μl Taq DN Polymerase (0,33 U/μl) 5 μl DN khuôn |
|
94°C/2’ |94°C/15” - 58°C/30” - 72°C/45”|x35 72°C/3’ |
95°C/5’ |97°C/40” - 64°C/40” - 72°C/1’30”|x3 |97°C/40” - 58°C/40” - 72°C/1’30”|x37 72°C/5’ |
* Bước 3. Điện di kiểm tra ADN sản phẩm PCR
- Kiểm tra sản phẩm PCR bằng điện di trên gel 3% (không bắt buộc).
* Bước 4. Qui trình lai ADN
- Trướ khi lai khởi động bể ổn nhiệt và máy lắc ổn nhiệt tới 45°C (± 0.5°C). Cho lọ Hybridization Buffer và Wash Solution A vào bể ổn nhiệt để làm ấm trước khi sử dụng
4.1. Lai ADN với teststrip (45°C; máy lắc ổn nhiệt)
- Kiểm tra nhiệt độ của bể ổn nhiệt và máy lắc. Đảm bảo đạt 45oC trước khi tiến hành.
- Để tất cả teststrip, DNT, Conjugate Solution, Wash Solution B và Color Developer ra nhiệt độ ph ng.
- Lấy máng lai và viết ký hiệu trên mỗi rãnh tương ứng với teststrip của mỗi người bệnh.
- Sử d ng kẹp hoặc nhíp sạch lấy teststrip cho 1 mẫu bệnh phẩm (chỉ cầm teststrip khi đã đeo bao tay!). Ghi ký hiệu ở ngoài vạch đánh dấu của teststrip sử d ng bút ch (không sử d ng bút bi, bút đánh dấu...).
- Trộn thành phần cho phản ứng lai theo bảng sau:
| β-globin stripassay |
|
• Hút 10 μl DNT vào góc của mỗi rãnh đã đánh dấu trong máng lai. • Thêm 10 μl sản phẩm PCR vào giọt DNT tương ứng. Trộn đều bằng pipette. (Dung dịch sẽ duy tr màu xanh) |
| α-globin stripassay/teststrip A | α-globin stripassay/teststrip B |
|
• Hút 20 μl DNT vào góc của mỗi rãnh đã đánh dấu trong máng lai. • Thêm 10 μl sản phẩm PCR A1 vào giọt DNT tương ứng. • Thêm 10 μl sản phẩm PCR A2 vào cùng một giọt. Trộn đều bằng pipette. (Dung dịch sẽ duy trì màu xanh). |
• Hút 10 μl DNT vào góc của mỗi rãnh đã đánh dấu trong máng lai. • Thêm 10 μl sản phẩm PCR B vào giọt DNT tương ứng. Trộn đều bằng pipette. (Dung dịch sẽ duy trì màu xanh). |
- Để yên 5 phút ở nhiệt độ phòng.
- Thêm 1 ml Hybridization Buffer (đã làm ấm tới 45°C) trong mỗi rãnh. Lắc máng lai nhẹ nhàng (màu xanh sẽ biến mất)
- Chèn teststrip hoặc teststrip B đã đánh dấu vào lần lượt các rãnh. Nhấn ch m hoàn toàn teststrip.
- Ủ 30 phút ở 45°C trong máy lắc ổn nhiệt, Tốc độ 250 rpm, đ y nắp khi ủ
- Kết thúc ủ, loại b đệm lai bằng pipet.
4.2. Rửa teststrip (45°C; máy lắc ổn nhiệt)
- Thêm 1 ml Wash Solution (đã làm ấm tới 45°C). Rửa nhanh (10 gi y). Loại bỏ dịch bằng pipet.
- Thêm 1 ml Wash Solution (45°C).
- Ủ 15 phút ở 45°C trong bể ổn nhiệt. Loại b dịch bằng pipet.
- Thêm 1 ml Wash Solution (45°C).
- Ủ 15 phút ở 45°C trong bể ổn nhiệt. Loại b dịch bằng pipet.
Sau bước này cài nhiệt độ và 25oC và mở nắp máy lắc.
4.3. Hiện màu (nhiệt độ phòng)
- Thêm 1 ml Conjugate Solution.
- Ủ 15 phút ở nhiệt độ ph ng trên máy lắc. Loại b dịch bằng pipet.
- Thêm 1 ml Wash Solution B. Rửa nhanh (10 gi y). Loại b dịch bằng pipet.
- Thêm 1 ml Wash Solution B.
- Ủ 5 phút ở nhiệt độ ph ng trên máy lắc. Loại b dịch bằng pipet.
- Thêm 1 ml Wash Solution B.
- Ủ 5 phút ở nhiệt độ ph ng trên máy lắc. Loại b dịch bằng pipet.
- Thêm 1 ml Color Developer.
- Ủ 15 phút ở nhiệt độ ph ng trong tối và trên máy lắc.
Chất nhuộm mầu tía sẽ xuất hiện trên phản ứng dương tính.
- Rửa teststrip vài lần với nước khử ion.
- Để teststrip khô trong tối trên giấy thấm.
Tránh để teststrip tiếp xúc với ánh sáng mạnh sau khi phát triển màu.
VI. NHẬN ĐỊNH KẾT QUẢ
- Kiểu gen của một mẫu x t nghiệm được xác định từ teststrip tương ứng, qua việc đối chiếu teststrip với thang đo.
- Kết quả chỉ được chấp nh n khi xuất hiện đủ 3 vạch: vạch Control trên cùng, vạch Control và vạch Control B.
- Mẫu dị hợp tử khi xuất hiện đ ng thời cả vạch đột biến và vạch kiểu dại
- Mẫu đ ng hợp tử một đột biến khi xuất hiện vạch đột và không xuất hiện vạch kiểu dại.
VII. NHỮNG SAI SÓT VÀ XỬ TRÍ
| SAI SÓT | XỬ TRÍ |
|
Lấy mẫu không đủ hoặc sai chất chống đông. |
Hướng dẫn qui cách lấy mẫu rõ ràng. |
| Thao tác pipet không chính xác. | Sử dụng pipet theo đúng thể tích qui định. |
| Tín hiệu phản ứng không rõ ràng. |
Bảo quản hóa chất đúng theo khuyến cáo của nhà sản xuất Thực hiện đúng, đủ các bước trong qui trình xét nghiệm. |
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật ngoại khoa chuyên khoa phẫu thuật tiết niệu - Bộ y tế 2017
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017

Thử nghiệm lâm sàng là gì? Các thử nghiệm lâm sàng được tiến hành như nào? Rủi ro và lợi ích của các thử nghiệm lâm sàng là gì? Bài viết dưới đây sẽ giúp bạn trả lời những thắc mắc về việc thử nghiệm lâm sàng ở trẻ em và gia đình.
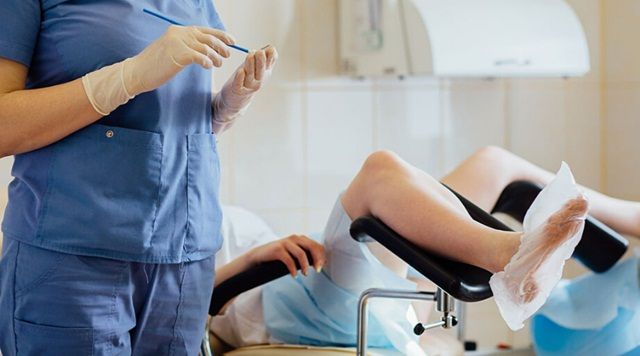
Xét nghiệm Pap, hay còn được gọi là phết tế bào cổ tử cung, vẫn là một phần cần thiết trong việc chăm sóc sức khỏe sau mãn kinh.
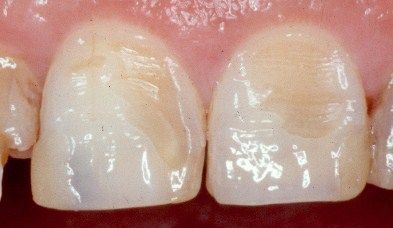
Nguyên nhân và cách điều trị mòn men răng

Câu chuyện về việc một phụ nữ quá tuổi, quyết định có con bằng việc thụ tinh trong tử cung, và tinh trùng được mua từ một người đàn ông.
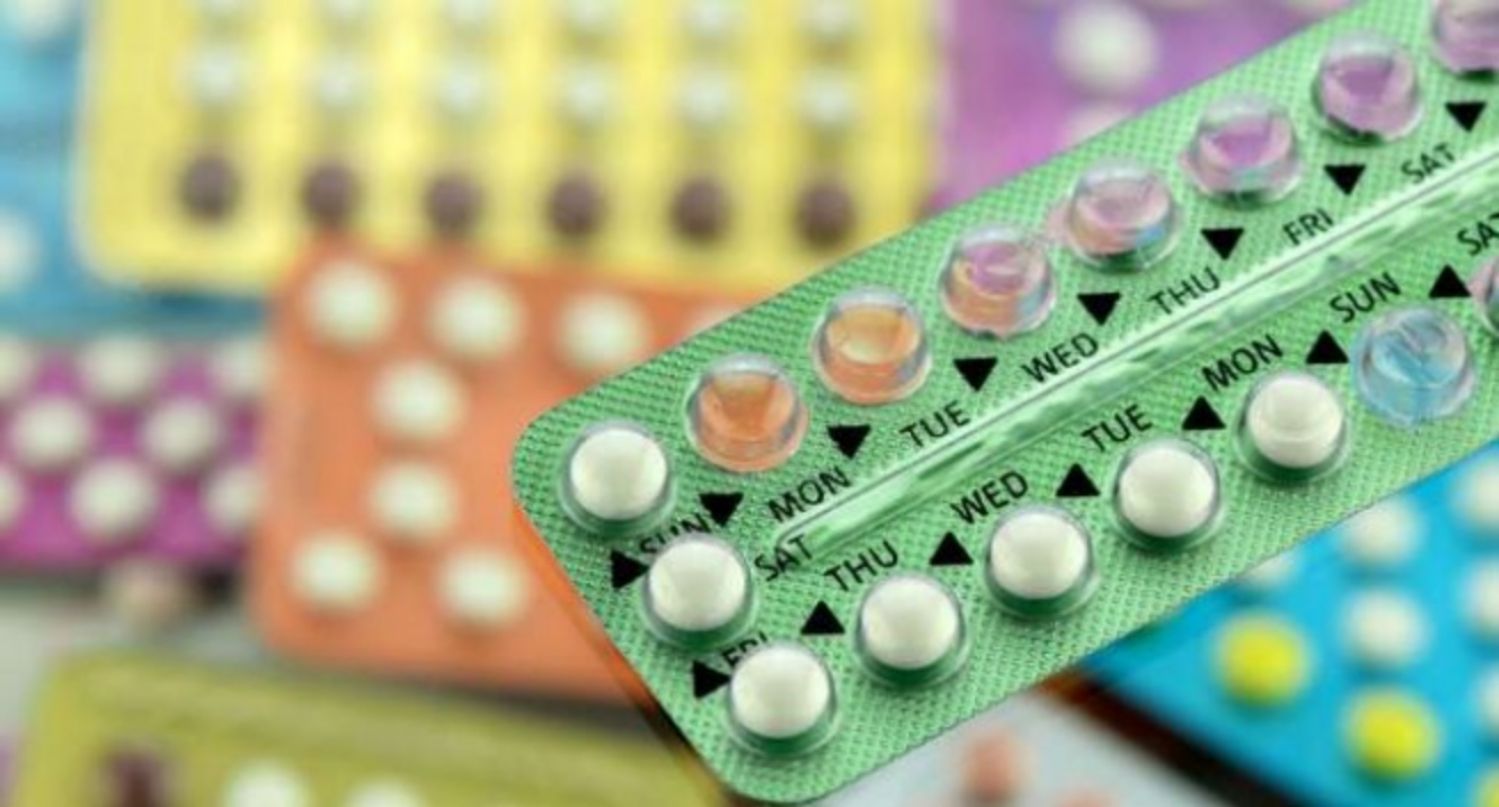
Nếu bạn đang nghĩ đến việc cố gắng mang thai sớm, thì đây là một vài điều bạn cần biết về việc dừng các biện pháp tránh thai.
- 1 trả lời
- 1303 lượt xem
Tôi nghe mọi người mách là lau người bằng bọt biển hoặc cho bé vào bồn tắm là có thể hạ sốt cho bé. Tôi có nên làm như vậy không? Mong bác sĩ cho tôi lời khuyên ạ!
- 1 trả lời
- 1675 lượt xem
- Bác sĩ cho tôi hỏi, bé nhà tôi có cần phải tiêm liều vắc xin bổ sung nhắc lại không, nếu xét nghiệm máu cho thấy bé đã miễn dịch với bệnh? Cảm ơn bác sĩ!
- 1 trả lời
- 1154 lượt xem
- Bác sĩ cho hỏi, các phản ứng nhạy cảm với vắc xin có di truyền từ bố mẹ sang con không ạ? Cảm ơn bác sĩ!
- 1 trả lời
- 1096 lượt xem
- Bác sĩ cho hỏi những thử nghiệm về độ an toàn của vắc xin đã đủ nghiêm ngặt chưa ạ? Các quy trình để đo độ an toàn của vắc xin là gì ạ?
- 1 trả lời
- 913 lượt xem
Bác sĩ cho hỏi, sử dụng liệu pháp quấn tảo biển nóng để làm đẹp khi đang mang thai có an toàn không ạ? Cảm ơn bác sĩ!