Xét nghiệm AFB nhuộm soi trực tiếp phương pháp nhuộm huỳnh quang đèn LED - Bộ y tế 2015
1. Mục đích
Mô tả kỹ thuật nhuộm soi trực tiếp tìm AFB (Acid- Fast- Bacilli) theo phương pháp nhuộm huỳnh quang sử dụng kính huỳnh quang đèn LED.
2. Bệnh phẩm
Đờm và cặn bệnh phẩm sau li tâm (không nhuộm huỳnh quang chủng vi khuẩn).
3. Trang thiết bị và vật liệu
Giống phương pháp nhuộm Ziehl – Neelsen. Thay thế KHV quang học bằng KHV huỳnh quang đèn LED.
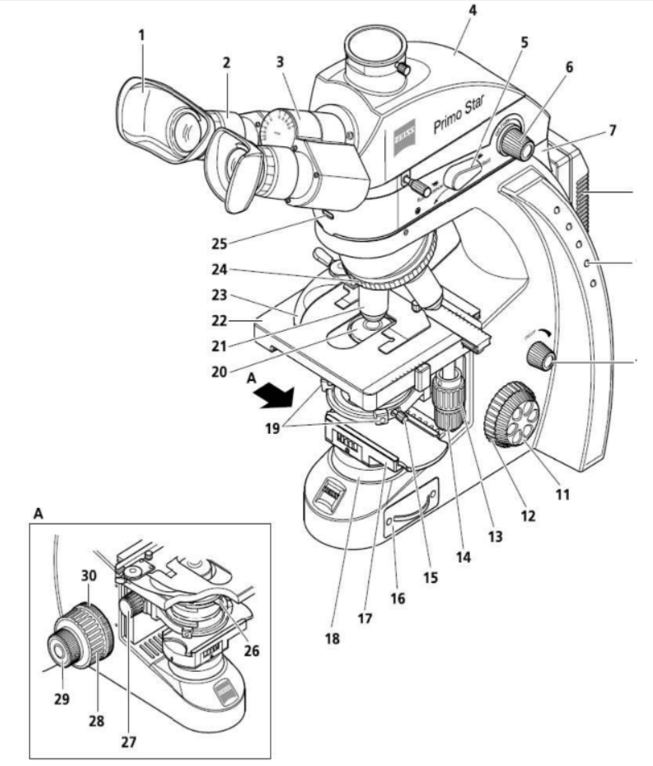
- Cấu tạo KHV đèn LED: 30 phần
- Diềm thị kính (có thể tháo ra nếu người sử dụng cảm thấy không thuận tiện).
- Thị kính.
- Ống gắn thị kính.
- Ống chứa hệ thống lăng kính.
- Cần chuyển đổi quang hệ (quang hệ truyền qua/quang hệ phản xạ).
- Nút bật/tắt và điều chỉnh cường độ chiếu sáng cho quang hệ phản xạ.
- Tay xách.
- Bộ chuyển nguồn điện.
- Cụm đèn báo cường độ chiếu sáng cho quang hệ truyền qua.
- Nút bật/tắt và điều chỉnh cường độ chiếu sáng cho quang hệ truyền qua.
- Nút điều chỉnh vi cấp (bên phải).
- Nút điều chỉnh vĩ cấp (bên phải).
- Nút điều chỉnh di chuyển mâm kính (chiều trái - phải).
- Nút điều chỉnh di chuyển mâm kính (chiều trước - sau).
- Chốt cố định tụ quang.
- Nguồn chiếu sáng.
- Gá phin lọc ánh sáng vàng.
- Màn trập (cố định).
- Cặp vít chỉnh tụ quang chính tâm.
- Tụ quang.
- Vật kính.
- Mâm kính.
- Cần kẹp lam kính.
- Vòng xoay gắn vật kính.
- Đèn báo nguồn chiếu sáng quang hệ phản xạ (màu xanh dương: bật; cường độ chiếu sáng tỷ lệ thuận với độ chiếu sáng của đèn báo).
- Cần điều chỉnh màn chập của tụ quang.
- Nút điều chỉnh theo chiều thẳng đứng.
- Nút điều chỉnh vĩ cấp (bên trái).
- Nút điều chỉnh vi cấp (bên trái).
- Vòng điều chỉnh độ mượt khi di chuyển nút vĩ cấp.
- Các bước sử dụng kính hiển vi huỳnh quang đèn LED: 8 bước
- Bước 1. Nối nguồn điện hoặc dùng pin. Đóng chắn sáng.
- Bước 2: Lựa chọn ánh sáng huỳnh quang (gạt nút ngược chiều kim đồng hồ phía”fluorescence”) ( công tắc số 5).
- Bước 3: Chỉnh nút on/of điều chỉnh ánh sáng huỳnh quang (số 6).
- Bước 4: Quan sát tiêu bản bằng vật kính 10 X, sử dụng vĩ cấp.
- Bước 5: Điều chỉnh khoảng cách giữa 2 ống thị kính để có 1 hình ảnh trùng nhau.
- Bước 6: Chỉnh vi cấp để có hình ảnh rõ nét.
- Bước 7: Chuyển vật kính 20 X để quan sát tìm AFB.
- Bước 8: Quan sát kỹ vi trường, sau đó chuyển vi trường khác theo chiều dài tiêu bản bằng nút di chuyển (số 13, 14).
Hình ảnh KHV huỳnh quang đèn LED
4. Hóa chất nhuộm huỳnh quang
4.1 Hóa chất tự pha
4.1.1. Dung dịch Auramine 0,1%
- Công thức:
- Auramin O: 1 gam
- Phenol: 30 gam
- Cồn 95% 100 ml
- Nước cất 870 ml
- Cách pha
- Hòa tan 30 gam phenol vào 100 ml cồn 950
- Thêm 1 gam Auramin O vào dung dịch trên,
- Trộn đều. Có thể sử dụng máy trộn,
- Cho nước cất vừa đủ 1000 ml,
- Lọc qua giấy lọc và chứa vào chai màu,
- Dán nhãn ghi rõ tên hóa chất, nồng độ, và ngày pha,
- Vặn chặt nút chai giữ trong tủ, tránh ánh sáng mặt trời.
- Hạn sử dụng 1 tháng.
4.1.2. Dung dịch cồn tầy acid HCl 0,5%
- Công thức:
- Cồn 700 995 ml
- HCl 5 ml
- Cách pha:
- Cho 995 ml cồn 700 vào bình 2 lít,
- Rót từ từ acid HCl vào bình, trộn đều,
- Dán nhãn ghi tên hóa chất, nồng độ và ngày pha,
- Vặn chặt nút chai giữ trong tủ, tránh ánh sáng mặt trời,
- Hạn sử dụng 1 tháng.
4.1.3. Dung dịch Methylene blue 0,3%
- Công thức:
- Methylene blue: 3 gam
- Nước cất: 1000 ml
- Cách pha:
- Hòa tan xanh methylen trong nước cất.
- Dán nhãn ghi tên hóa chất, nồng độ và ngày pha.
- Vặn chặt nút chai giữ trong tủ, tránh ánh sáng mặt trời.
- Hạn sử dụng 1 tháng.
4.2. Hóa chất huỳnh quang nhanh (bô kít):
- QBC. FAST AuraminO: chai 250 ml màu nâu.
- QBC. FAST Decolerizer/Quencher: chai 250 ml màu xanh.
- Bộ hóa chất trong hạn sử dụng.
5. Nguyên lý
- Mycobacteria có lớp vách sáp dày, khi nhuộm Auramine thấm vào vi khuẩn do có phenol trong dung dịch nhuộm, khi tẩy màu bằng dung dịch acid-cồn AFB vẫn giữ được màu vàng của auramine do có tính kháng acid, nhuộm nền bằng xanh methylene để tạo màu nền tối, thuần nhất cho ánh sáng phát quang. Khi soi bằng ánh sáng huỳnh quang AFB phát quang màu vàng sáng tương phản rõ ràng trên nền tối.
- Kính hiển vi huỳnh quang có ưu điểm là soi nhanh hơn KHV quang học (ánh sáng trắng) với nhuộm Ziehl – Neelsen và đặc biệt có giá trị ở những phòng xét nghiệm có khối lượng công việc lớn. Kĩ thuật này cũng có độ nhạy cao hơn ở những mẫu bệnh phẩm ít vi khuẩn vì số vi trường được quan sát nhiều hơn.
6. Các bước thực hiện
6.1. Chuẩn bị tiêu bản
Các bước làm tiêu bản, cố định tiêu bản giống như phương pháp nhuộm ZN.
6.2. Các bước nhuộm huỳnh quang( hóa chất tự pha)
6.2.1: Nhuộm màu Auramine
- Xếp tiêu bản theo thứ tự trên giá nhuộm, mỗi tiêu bản cách nhau ít nhất 1 cm.
- Phủ dung dịch Auramine 0,1 % kín toàn bộ bề mặt tiêu bản.
- Để ít nhất 15 phút.
- Rửa tiêu bản nhẹ nhàng cho trôi hết thuốc nhuộm.
- Nghiêng tiêu bản cho ráo nước.
6.2.2 Tẩy màu
- Phủ đầy dung dịch acid - cồn 0,5% lên tiêu bản, để 2 phút.
- Rửa nước. Nghiêng tiêu bản cho ráo nước.
- Sau khi rửa, các tiêu bản không còn màu vàng.
- Nếu tiêu bản vẫn còn màu vàng, tẩy lại lần 2, thời gian từ 1 – 2 phút cho đến khi hết màu vàng, rửa lại nước.
6.2.3. Nhuộm nền
- Phủ đầy dung dịch xanh Methylene 0,3% lên tiêu bản.
- Để 1 - 2 phút.
- Rửa nước, nghiêng tiêu bản cho ráo nước.
6.2.4. Làm khô tiêu bản
- Để tiêu bản khô tự nhiên ở nhiệt độ PXN hoăck làm khô ở máy làm khô tiêu bản.
- Xếp tiêu bản vào hộp tránh ánh sang.
6.3. Các bước nhuộm huỳnh quang nhanh (bộ kit QBC)
6.3.1. Nhuộm màu Auramine
- Xếp tiêu bản theo thứ tự trên giá nhuộm, mỗi tiêu bản cách nhau ít nhất 1 cm.
- Phủ dung dịch FAST AuraminO kín vết dàn.
- Để 1-2 phút.
- Rửa tiêu bản nhẹ nhàng cho trôi hết thuốc nhuộm.
- Nghiêng tiêu bản cho ráo nước.
6.3.2. Tẩy màu và nhuộm nền
- Phủ dung dịch FAST Decolerizer/Quencher kín vết dàn.
- Để 1 phút.
- Rửa nước. Nghiêng tiêu bản cho ráo nước.
- Để tiêu bản khô tự nhiên ở nhiệt độ PXN hoăc làm khô ở máy làm khô tiêu bản
- Xếp tiêu bản vào hộp tránh ánh sáng.
Hình ảnh mô tả các bước nhuộm huỳnh quang bằng hóa chất tự pha (phụ lục 16)
7. Đọc tiêu bản, ghi chép và báo cáo kết quả
7.1. Lấy vi trường
- Bật nguồn điện.
- Lựa chọn ánh sáng huỳnh quang (gạt nút ngược chiều kim đồng hồ phía ”fluorescence”).
- Chỉnh nút on/of điều chỉnh ánh sáng huỳnh quang.
- Xoay vật kính x10 vào trục quang học.
- Đặt tiêu bản lên mâm kính, sử dụng vật kính x10 để lấy vi trường.
- Điều chỉnh khoảng cách giữa 2 ống thị kính để có 1 hình ảnh trùng nhau.
- Xoay vật kính x 20 vào trục quang học.
- Chỉnh vi cấp để có hình ảnh rõ nét.
7.2. Cách soi tiêu bản và nhận định kết quả
- Cách soi: cần phải hệ thống và chuẩn hóa, soi dòng giữa từ trái sang phải (tương đương với 30 vi trường). Điều chỉnh ốc vi cấp cho hình ảnh rõ nét nhất, quan sát kỹ từ ngoại vi vào trung tâm vi trường để phát hiện AFB. Đọc xong vi trường thứ nhất, chuyển sang đọc các vi trường kế tiếp cho đến hết dòng. Khi cần đọc > 1 dòng, chuyển dòng kế tiếp từ phải qua trái.
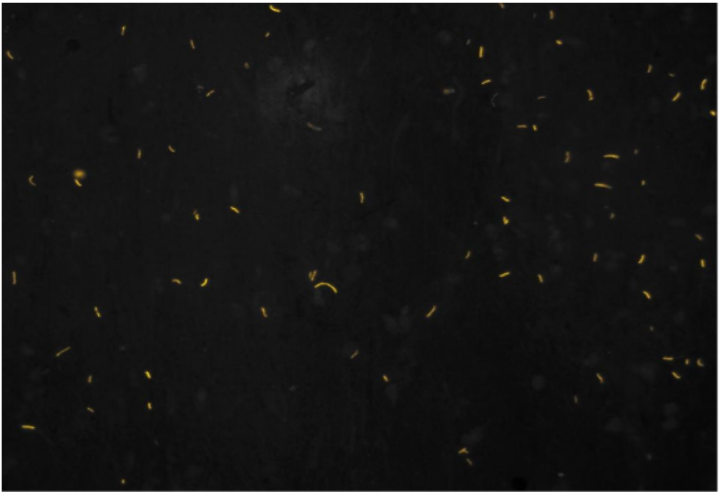
- Hình thể AFB trên tiêu bản nhuộm huỳnh quang: AFB dạng trực khuẩn mảnh, màu vàng phát quang trên nền tối, AFB đứng riêng rẽ hoặc thành từng đám. Chú ý: Một số thành phần khác có thể bắt màu vàng phát quang hoặc không nhưng hình thể không điển hình.
- Lưu ý: khi cần xác định rõ hình ảnh AFB, chuyển vật kính 40, sau đó lại chuyển về vật kính 20 để tiếp tục nhận định kết quả.
- Phân loại kết quả như bảng 2.
Hình ảnh AFB trên tiêu bản nhuộm huỳnh quang
Bảng 2: Quy định ghi kết quả xét nghiệm AFB nhuộm huỳnh quang
|
Số lượng AFB quan sát bằng vật kính 20 X |
Kết quả | Kết quả |
| 0 AFB/ 1 dòng | Âm tính | Âm tính |
| 1–29 AFB/ 1 dòng | Dương tính | Ghi số lượng AFB cụ thể |
| 30–299 AFB/ 1 dòng | Dương tính | 1+ |
|
10–100 AFB/ 1 VT (soi ít nhất 10 VT) |
Dương tính | 2+ |
|
>100 AFB/ 1 VT (soi ít nhất 4 VT) |
Dương tính | 3+ |
Ghi chú: 1 dòng tương đương 30 vi trường, VT: vi trường
Bảng 3: So sánh ghi kết quả xét nghiệm AFB 2 phương pháp nhuộm
| Kết quả |
Nhuộm ZN (phóng đại 1000 lần) 1 dòng = 2cm = 100VT |
Nhuộm huỳnh quang (phóng đại 200 lần) 1 dòng = 2cm = 20VT |
Nhuộm huỳnh quang (phóng đại 400 lần) 1 dòng = 2cm = 40VT |
| Âm tính | 0 AFB / 100 VT | 0 AFB/ 20 VT | 0 AFB / ít nhất 40 VT |
|
Ghi số lượng AFB cụ thể |
1 - 9 AFB / 100 VT | 1–29 AFB/ 20 VT | 1-19 AFB / 40 VT |
| 1+ | 10 - 99 AFB / 100 VT | 30–299 AFB/ 20 VT |
20-199 AFB/ 40 VT (Soi ít nhất 40 VT) |
| 2+ |
1 -10 AFB /1 VT (soi ít nhất 50 VT) |
10–100 AFB/ 1 VT (soi ít nhất 10 VT) |
5-50 AFB/ 1 VT (Soi ít nhất 20 VT) |
| 3+ |
>10 AFB / 1 VT (soi ít nhất 20 VT) |
>100 AFB/ 1 VT (soi ít nhất 4 VT) |
>50 AFB/ 1 VT (Soi ít nhất 8 VT) |
7.3. Ghi chép và báo cáo kết quả
- Kiểm tra số XN trên tiêu bản trùng với số ghi trên phiếu XN.
- Ghi kết quả soi kính vào phiếu XN và sổ xét nghiệm.
- Ghi ngày tháng làm XN và ký tên vào phiếu và sổ xét nghiệm.
- Kết quả dương tính phải ghi bằng mực đỏ trong sổ xét nghiệm.
- Kết quả xét nghiệm được trả ngay sau khi đọc kết quả.
7.4. Lưu trữ tiêu bản
- Không ghi kết quả soi trên tiêu bản.
- Xếp các tiêu bản vào hộp đựng tiêu bản theo thứ tự trong sổ xét nghiệm để phục vụ cho công tác kiểm định tiêu bản.
- Hộp tiêu bản lưu ở nơi thoáng, khô ráo và tránh ánh nắng trực tiếp.
8. Kiểm tra chất lượng
8.1. Kiểm tra chất lượng thuốc nhuộm
- Kiểm tra chất lượng thuốc nhuộm ngay sau khi pha lô mới:
- Chuẩn bị sẵn lô tiêu bản từ mẫu đờm biết trước kết quả âm tính và dương tính ở mức độ 1 +.
- Mỗi lô thuốc nhuộm mới pha nhuộm 3 tiêu bản dương và 3 tiêu bản âm đúng qui trình kĩ thuật.
- Kết quả thuốc nhuộm đạt chất lượng: tiêu bản dương thấy AFB bắt màu vàng phát quang trên nền tối, không thấy cặn thuốc nhuộm, tiêu bản âm không thấy AFB.
- Kết quả thuốc nhuộm không đạt chất lượng: tiêu bản dương không thấy AFB hoặc AFB bắt màu vàng nhạt không phát quang hoặc phát quang yếu, nền không tối, có nhiều thành phần khác phát quang, thấy cặn thuốc nhuộm, tiêu bản âm thấy AFB.
- Kiểm tra chất lượng thuốc nhuộm hàng tuần: nhuộm chứng dương và âm cùng mẻ, nhuộm tiêu bản thông thường. Đọc kết quả chứng dương và chứng âm trước khi đọc tiêu bản của người bệnh.
- Khi kết quả kiểm tra không đạt, phải xem xét lại toàn bộ quá trình từ thuốc nhuộm, tiêu bản kiểm tra đến kỹ thuật nhuộm soi, nhuộm thêm lô tiêu bản chứng mới nếu kết quả vẫn không đạt phải hủy bỏ thuốc nhuộm.
- Chỉ sử dụng và cấp phát thuốc nhuộm đã kiểm tra đảm bảo chất lượng.
- Phải có sổ pha, kiểm tra, quản lý và cấp phát thuốc nhuộm.
- Hạn sử dụng thuốc nhuộm 1 tháng.
- Chai lọ đựng thuốc nhuộm phải được dán nhãn và hạn sử dụng, được bảo quản nơi thoáng mát, khô ráo và tránh ánh nắng mặt trời.
8.2. Kiểm tra chất lượng tiêu bản
8.2.1. Tiêu chuẩn đánh giá (3 tiêu chuẩn)
8.2.1.1. Kích thước tiêu bản
Xem mục 9.2.2. Kích thước tiêu bản (Bài Xét nghiệm AFB nhuộm soi trực tiếp bằng phương pháp nhuộm Ziehl – Neelsen).
8.2.1.2 Độ mịn
Xem mục 9.2.3. Độ mịn (Bài Xét nghiệm AFB nhuộm soi trực tiếp bằng phương pháp nhuộm Ziehl – Neelsen).
8.2.1.3 Độ dày
Xem mục 9.2.4. Độ dày (Bài Xét nghiệm AFB nhuộm soi trực tiếp bằng phương pháp nhuộm Ziehl – Neelsen).
8.2.2. Phương pháp đánh giá
- Thực hiện kiểm định tiêu bản theo phương pháp kiểm định theo lô (LQAS).
- Đánh giá chất lượng tiêu bản nhuộm theo 3 tiêu chuẩn: kích cỡ, độ dày và độ mịn.
8.3. Nguyên nhân sai kết quả dương
8.3.1. Nguyên nhân sai dương
- Chất lượng thuốc nhuộm không đạt (nước cất pha Auramine nhiễm AFB).
- Kỹ thuật nhuộm chưa đúng: các tiêu bản để quá sít, xối nước mạnh AFB từ tiêu bản dương tràn sang tiêu bản khác, tẩy màu chưa đủ..).
- Nhận định sai AFB do XNV thiếu kinh nghiệm nhầm lẫn với các chất phát quang khác (thức ăn, cặn Auramine..).
- Chất lượng kính kém hoặc điều chỉnh chưa đúng.
8.3.2. Nguyên nhân sai âm
- Chất lượng bệnh phẩm không đạt (không chọn được mảnh đờm để dàn tiêu bản).
- Chất lượng thuốc nhuộm không đạt (nồng độ Auramine <0,1%, nồng độ acid cồn quá 0,5%).
- Kỹ thuật nhuộm chưa đúng: Tẩy màu quá, thời gian nhuộm Auramine không đủ, nhuộm nền quá lâu.
- Cố định tiêu bản quá nóng.
- Đọc tiêu bản chưa đủ một dòng.
- Thời gian từ khi nhuộm và đọc quá lâu (tiêu bản không giữ trong hộp tối).
8.4. Bảo quản kính hiển vi
- Đặt KHV ở nơi vững chắc, khô ráo, không có bụi, tránh ánh nắng trực tiếp. Độ ẩm cao có thể làm mốc bộ phận quang học (vật kính, thị kính, tụ quang..) và bộ phận cơ học bị han rỉ.
- Tránh va chạm mạnh làm hỏng kính hiển vi.
- Chỉ sử dụng ốc vi cấp khi cần chỉnh rõ nét hình ảnh.
- Lau bộ phận quang học bằng giấy lau chuyên dụng.
- Vệ sinh kính sau mỗi ngày sử dụng.
- Khi không sử dụng để kính ở trạng thái “nghỉ”: tắt nguồn điện, xoay vật kính ra khỏi vị trí quan sát, nâng mâm kính hết cỡ và phủ kính tránh bụi.
- Nếu có điều kiện bảo quản KHV trong tủ bảo quản kính chuyên dụng.
- Nếu phát hiện kính bị hỏng tuyệt đối không được tự ý tháo ra sửa chữa phải báo người có trách nhiệm giải quyết.
9. Thực hành an toàn PXN (giống phương pháp nhuộm ZN)
Xem mục 9. Thực hành an toàn của bài xét nghiệm AFB nhuộm soi trực tiếp phương pháp nhuộm ZIEHL – NEELSEN.
Hướng dẫn chẩn đoán, điều trị và dự phòng bệnh lao - Bộ y tế 2015
Hướng dẫn quy trình kỹ thuật chuyên ngành Vi sinh - Bộ y tế 2018
Hướng dẫn quy trình kỹ thuật chuyên ngành Vi sinh - Bộ y tế 2018
Hướng dẫn quy trình kỹ thuật chuyên ngành Vi sinh - Bộ y tế 2018
Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch - Dị ứng - Sinh học phân tử - Bộ y tế 2017

Mãn kinh là một quá trình sinh lý tự nhiên ở phụ nữ, xảy ra khi buồng trứng ngừng phóng trứng trưởng thành vào mỗi tháng và cơ thể tạo ra ít horTronmone estrogen, progesterone hơn.
Với các phương pháp xét nghiệm HIV hiện nay thì việc chẩn đoán sai là điều rất hiếm khi xảy ra. Tuy nhiên trong một số ít trường hợp, xét nghiệm HIV cho kết quả dương tính giả hoặc âm tính giả.

Hội chứng bàng quang tăng hoạt là tình trạng buồn tiểu liên tục hoặc tiểu gấp, khó kiểm soát. Tình trạng này làm gián đoạn các hoạt động hàng ngày, gây ảnh hưởng không nhỏ đến cuộc sống và còn khiến người bệnh cảm thấy không thoải mái. Bàng quang tăng hoạt còn có thể gây tiểu không tự chủ. Có một số liệu pháp và bài tập có thể giúp tăng cường cơ bàng quang và cải thiện khả năng kiểm soát bàng quang, nhờ đó giảm các triệu chứng bàng quang tăng hoạt. Hai trong số những phương pháp phổ biến là bài tập Kegel và rèn luyện bàng quang.
Có nhiều phương pháp điều trị bàng quang tăng hoạt, gồm có thay đổi lối sống, dùng thuốc làm giãn cơ bàng quang hay tiêm Botox vào bàng quang. Kích thích điện thần kinh chày qua da (percutaneous tibial nerve stimulation) cũng là một phương pháp điều trị bàng quang tăng hoạt.
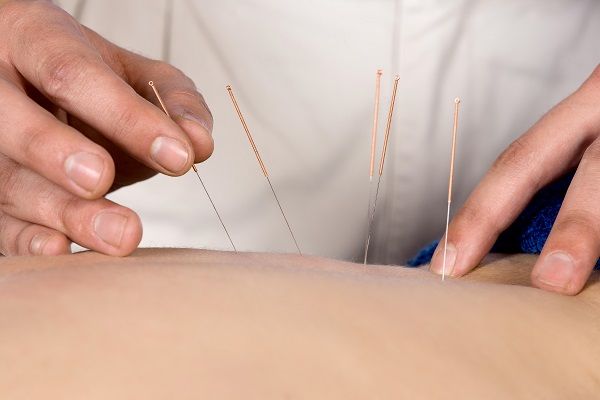
Bên cạnh các phương pháp điều trị y tế như dùng thuốc, các phương pháp điều trị thay thế như thực phẩm chức năng, thảo dược, liệu pháp hành vi, châm cứu, phản hồi sinh học cũng có thể giúp làm giảm các triệu chứng bàng quang tăng hoạt.
- 1 trả lời
- 1022 lượt xem
Vợ em sinh mổ 1 bé trai và 1 bé gái tại bệnh viện Từ Dũ. Khi sinh ra vì mẹ không đủ sữa nên nhà em sốt ruột đã cho 2 bé bú sữa trực tiếp của 1 chị cùng phòng sanh. Nếu chị kia bị bệnh truyền nhiễm thì hai bé nhà em có bị lây không ạ? Và khi nào thì các bé có thể làm xét nghiệm để biết bé có bị bệnh truyền nhiễm gì không?
- 1 trả lời
- 590 lượt xem
Bác sĩ ơi, vì không biết mình đã mang thai 4 tuần nên em đã lỡ đi nhuộm tóc mất rồi. Nhuộm tóc một lần như thế thì liệu có ảnh hưởng gì đến em bé không?
- 1 trả lời
- 912 lượt xem
Em vừa sinh bé xong thì nên vắt sữa ra bình hay cho bé bú trực tiếp vú mẹ ạ? Thời điểm tốt nhất để cho bé bú bình là khi nào ạ?
- 0 trả lời
- 672 lượt xem
Bé nhà em đang được 3 tháng tuổi. Hai hôm nay bé nhà em hay hắt xì rồi ho có đờm nữa. Có phương pháp tự nhiên nào để chữa ho cho bé không ạ? Vì em không muốn bé dùng thuốc tây ạ.
- 1 trả lời
- 776 lượt xem
Lần mang thai trước, em đã buộc phải bỏ thai (7 tháng) bằng phương pháp sinh non vì thai mắc phải hội chứng patau khá nặng. Bác sĩ có khuyên 2 tháng sau, hai vợ chồng nên đến Bv khám lại để tầm soát cho lần mang thai sau. Nhưng từ đó đến nay (khoảng 5 tháng), em chưa sắp xếp để vào khám lại được thì giờ em phát hiện ra mình đã có thai được khoảng 2 tuần. Em đang rất lo lắng, không biết nên thế nào - Mong được bác sĩ tư vấn dùm?